Сплавы*
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| С | СА | СБ | СВ | СГ | СД | СЕ | СЖ | СИ | СК | СЛ | СМ | СН | СО | СП | СР | СС | СТ | СУ | СФ | СХ | СЦ | СЧ | СЪ | СЫ | СЬ | СЭ | СЮ | СЯ |
| СПА |
| СПЕ |
| СПИ |
| СПЛ |
| СПО |
| СПР |
| СПУ |
| СПЮ |
| СПЯ |
Сплавы* (хим.). — До самого последнего времени о природе Сплавы* не существовало точных и верных представлений и они вместе с растворами, стеклами и изоморфными смесями относились к классу неопределенных химических соединений. В настоящее время с очевидностью доказано, что, вообще говоря, Сплавы* представляют простое сопоставление двух (или нескольких) тел и таким образом являются механической смесью, физически неоднородной. Лишь в некоторых частных случаях Сплавы* могут обладать полной однородностью, а именно: 1) если взятые металлы способны соединяться друг с другом и давать определенное химическое соединение и 2) если взятые металлы (или металл и определенное соединение) способны образовывать изоморфную смесь или твердый раствор. Таким образом, по своему строению, сплавы всего более приближаются к массивным горным породам, изучаемым петрографией, каковы, например, граниты, порфиры и т. п., и сообразно с этим, та отрасль знания, которая занимается изучением Сплавы*, носит название металлография. Эта отрасль науки, развившаяся лишь за последние годы, могла возникнуть только после тех успехов, которые сделало учение о растворах и подвижных равновесиях, и в короткое время достигла значительных результатов, благодаря приложению правила фаз (см.) и применению микроскопа к исследованию строения Сплавы*
Возможность приложения правила фаз к суждению о строения Сплавы* явствует из того, что сплавы образуются при затвердевании жидкого раствора взятых металлов. Как известно, для получения Сплавы* или прямо расплавляют взятые металлы и полученный таким образом металлический раствор охлаждают, или же один металл берется в жидком виде — расплавленный, а другой растворяется в нем в твердом виде. Во всяком случае, образование твердых Сплавы* происходит путем застывания истинного жидкого раствора металлов и представляет обратимый процесс; таким образом, при температуре затвердевания твердый Сплавы* и жидкий раствор находятся в состоянии равновесия и являются фазами гетерогенной системы. Поэтому, как и при растворах, по изменению температур застывания Сплавы* можно судить о том, как относятся взятые металлы друг к другу. Таким образом, определение кривых плавкости Сплавы* может служить методом для исследования Сплавы* С помощью этого метода взаимное отношение металлов друг к другу изучено довольно подробно и позволяет все Сплавы* разбить на три главные группы:
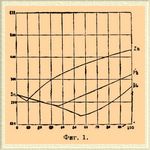
1) взятые металлы A и B не оказывают никакого взаимодействия друг на друга. В этом только случае жидкий Сплавы* является однородным телом — раствором в обычном смысле этого слова; при затвердевании он распадается на свои компоненты A и B так, что твердый Сплавы* является механической смесью взятых металлов A и B. Если выражать графически изменение температур затвердевания этих Сплавы*, откладывая по оси абсцисс процентный состав, а по оси ординат температуры затвердевания, то кривая плавкости изобразится двумя ветвями, спускающимися к оси абсцисс и пересекающимися в некоторой точке. В самом деле, если в расплавленном металле A растворять все большие и большие количества металла B, то, согласно закону Рауля, температура застывания этих растворов будет все более и более понижаться и графически выразится кривой, спускающейся к оси абсцисс. Точно также, если в расплавленном металле B растворять все большие и большие количества металла A, то также произойдет понижение температур затвердевания, которое выразится второй ветвью, также спускающейся к оси абсцисс. Очевидно эти кривые должны пересекаться в некоторой точке, отвечающей Сплавы* такого состава, когда при одной и той же температуре будут одновременно выделяться в твердом виде оба металла. Эта точка при водных растворах отвечает так называемому криогидрату; в случае Сплавы* она называется эвтектической точкой, т. е. точкой, отвечающей наиболее легкоплавкому Сплавы*, так как ниже температуры эвтектической точки никакой Сплавы* металлов A и B не может существовать в жидком состоянии. Примером таких Сплавы* могут служить Сплавы* олова и цинка, олова и свинца, олова и висмута и др. (фиг. 1).
Фиг. 1.
Из рассмотрения этих кривых следует, что постоянную температуру застывания такие Сплавы* будут иметь только в том случае, если состав их точно отвечает эвтектической точке. В самом деле, если взять, например, Сплавы* олова и висмута, лежащий левее эвтектической точки, например Сплавы*, состоящий из 80% Sn и 20% Bi, то он начнет затвердевать при 200° Ц. и при этом в твердом виде будут выпадать только кристаллы олова. По мере того, как олово будет выкристаллизовываться, жидкий раствор будет все более и более обогащаться висмутом и, следовательно, температура его застывания будет понижаться. Так будет происходить до тех пор, пока состав жидкой части не достигнет эвтектической точки, тогда вместе с оловом начнет выделяться и висмут, и состав жидкой части будет оставаться без изменения до самого конца застывания. Подобное же рассуждение применимо и к Сплавы* с избытком висмута. Таким образом, всякий Сплавы* затвердевает так, что температура все время понижается, причем жидкая часть приближается к составу, отвечающему эвтектической точке, и когда он достигнет этой точки, то температура остается постоянной до конца затвердевания. Это вполне согласно с правилом фаз (см.): в начале затвердевания система моновариантная, т. е. число фаз на 1 превышает число действующих тел: 2 вещества — Sn и Bi и 3 фазы — парообразная, жидкая и твердая; когда жидкая часть достигает эвтектической точки, система переходит в нонвариантную, т. е. число фаз на 2 превышает число действующих тел: 2 вещества и 4 фазы — парообразная, жидкая и две твердых.
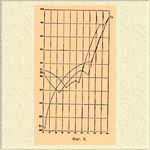
2) Металлы A и B образуют определенное химическое соединение Am Bn. В этом случае соединение Am Bn играет роль самостоятельного металла и все сплавы распадаются на две группы: сначала образуются Сплавы* металла A и соединения Am Bn, a потом Сплавы* соединения Am Bn и металла B. Каждая из групп представляет те же явления, которые были разобраны выше. Таким образом, кривая плавкости будет состоять из 3-х ветвей, как это видно на фиг. 2; она имеет 2 minimum'а и 1 maximum, который отвечает определенному соединению Am Bn.
Фиг. 2.
Это соединение с каждым из компонентов A и B образует эвтектические смеси, которые отвечают munimum'ам. Примером таких Сплавы* могут служить Сплавы* сурьмы и меди, кадмия и меди и др.; определенные соединения, отвечающие этим парам, выражаются формулами SbCu 3 и Cd 3 Cu. Постоянной температурой затвердевания будут обладать Сплавы*, отвечающие эвтектическим точкам, и кроме того, Сплавы*, отвечающий определенному соединению. В случае, если компоненты A и B образуют два соединения, кривая плавкости становится еще сложнее: она имеет 2 maximum'а, отвечающие определенным соединениям, и 3 эвтектические точки, как это нетрудно увидеть. Примером могут служить Сплавы* алюминия и меди (фиг. 2), образующие два соединения, Al 2 Cu и AlCu 3.
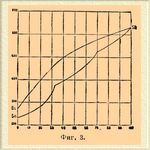
3) Металлы A и B образуют изоморфную смесь. В этом случае кривая плавкости не имеет ни maximum'ов, ни minimum'ов и приближается к прямой, соединяющей температуры плавления чистых металлов. Примером таких Сплавы* могут служить сурьма и висмут (фиг. 3), оба кристаллизующиеся в гексагональной системе, золото и серебро (фиг. 4), образующие кристаллы правильной системы. Температуры затвердевания этих Сплавы* являются постоянными при всяком составе или же изменяются в очень узких пределах (см. ниже).
Фиг. 3.
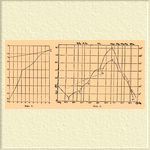
Фиг. 4. Фиг. 5.
Рассмотренные три типических случая взаимодействия металлов при сплавлении можно считать основными, но они не охватывают явления Сплавы* во всей совокупности и в действительности в них наблюдаются более сложные соотношения. Здесь прежде всего следует отметить два обстоятельства: разложение сложных металлических соединений при плавлении и образование так называемых твердых растворов. Мы здесь вкратце рассмотрим эти явления, отсылая за подробностями к соответствующим статьям. Подобно тому как многие соединения солей с кристаллизационной водой не могут быть при обыкновенных условиях превращены в жидкое состояние, но распадаются на твердую соль (безводную или с иным содержанием воды) и водный раствор, так и многие соединения металлов не могут существовать в жидком состоянии. Благодаря этому — кривая плавкости не может быть доведена до maximum'a, отвечающего образованию определенного соединения, и, при некоторой определенной температуре, жидкий Сплавы*, еще не достигнув состава соединения, начинает при затвердевании выделять кристаллы другого высшего соединения. Вследствие этого в этой точке происходит разрыв непрерывности и затем начинается новая ветвь кривой, отвечающая выделению высшего соединения. Таким образом, температура затвердевания все время повышается и существование определенных соединений обнаруживается не maximum'ами, но переломами кривой. Примером таких Сплавы* могут служить Сплавы* ртути с натрием и калием (фиг. 5). Калий и натрий образуют с ртутью прочные соединения состава KHg 2 и NaHg 2, отвечающие наивысшим температурам затвердевания. Но, кроме этих соединений, Na и K образуют еще несколько других, менее прочных и разлагающихся ниже своей температуры плавления. Поэтому кривые плавкости не представляют непрерывности, но дают несколько особенных точек, так называемых точек перехода. Так, для натрия кривая ABCDEFGHN после эвтектической точки B на восходящей ветви дает 4 таких точки C, D, E, F, и в этих точках состав выпадающей твердой фазы претерпевает изменение. Так, начиная от точки B до точки O выделяется соединение, кристаллизующееся в гексагональных таблицах, состав которых близок к формуле Na 5Hg2. В точке C эти кристаллы плавятся с образованием октаэдрических кристаллов с меньшим уже содержанием натрия и кривая CD отвечает выделению этого нового соединения и т. д. На основании переходных точек можно с известной степенью вероятности определять состав соединений, подыскивая простейшие кратные отношения в пределах между двумя соседними точками перехода. Так, для соединения, выпадающего на отрезке BC, пределы определяются точками C и E (D не вполне достоверна). В точке O Сплавы* имеет состав 2,5 Na и 1Hg, в точке E — состав отвечает формуле HgNa, следовательно, выражая состав искомого соединения формулой HgNa n, для n получаем пределы 2,5 и 1, простейшие отношения будут 5:2 и 2:1, т. е. соединение отвечает или формуле Na 5Hg2, или формуле Na 2Hg.
Под именем твердых растворов подразумевают однородные кристаллические тела, заключающие два вещества в неопределенных пропорциях. Частным случаем твердых растворов являются изоморфные смеси, которые образуются телами, имеющими сходственное химическое строение и кристаллизующимися в одной и той же системе. Образование твердых растворов наблюдается в Сплавы* чрезвычайно часто и зависимость их от кристаллографического строения пока неизвестна. В случае образования твердых растворов кривая плавкости может резко отличаться от нормального вида. Самое затвердевание жидкого Сплавы* при этом происходит иначе. В этом случае жидкий раствор двух компонентов A и B при застывании выделяет кристаллы не чистого металла A или B, но кристаллы A с содержанием некоторого количества металла B или наоборот. При этом надо различать два главных случая: во-первых, если концентрация выпадающего твердого раствора имеет некоторый предел. Тогда жидкий Сплавы*, концентрация которого менее предельной концентрации твердого раствора, затвердевает весь в некоторых пределах температуры, не достигая эвтектической точки, если же жидкий Сплавы* обладает концентрацией, превышающей предельную концентрацию твердого раствора, то затвердевание идет обычным порядком, с тем только различием, что вместо компонента A выделяется твердый раствор предельной концентрации. Во-вторых, твердый раствор может иметь любую концентрацию. В этом случае жидкий сплав всякой концентрации затвердевает в узких пределах температур и кривая плавкости не имеет minimum'а, отвечающего эвтектической точке. Сплавы цинка и меди (фиг. 4) могут служить примером такого явления. Цинк и медь образуют соединение Zn 2 Cu, которое дает твердые растворы и с медью, и с цинком. Благодаря этому, кривая плавкости состоит лишь из двух ветвей, пересечение которых отвечает этому соединению.
Существование твердых растворов с несомненностью может быть обнаружено при помощи метода плавкости только в случаях, если образуются твердые растворы большой концентрации, когда ход кривых плавкости значительно уклоняется от нормального вида. При образовании же твердых растворов слабой концентрации — кривые мало уклоняются и при обычных способах определения температуры (при помощи пирометра Ле Шателье) это уклонение не может быть обнаружено. В этом отношении чрезвычайно ценные результаты дает метод электровозбудительных сил. Сущность этого метода заключается в следующем: если в раствор какого-нибудь электролита, например серной кислоты, погрузить две пластинки каких-нибудь двух металлов и соединить их проводником, то эти металлы электризуются и дают некоторую разность потенциалов, вследствие чего в проводнике образуется гальванический ток. Если одну из этих пластинок заменять различными другими металлами, то каждый раз будет получаться определенная электровозбудительная сила, характерная для взятой пары металлов. Возьмем две пластинки одного и того же металла, например цинка, погрузим их в сосуд со слабой серной кислотой и соединим их металлическим проводником — тока, как известно, не будет. Опустим в тот же сосуд третью пластинку другого металла, например меди, и приведем ее в соприкосновение с одной из цинковых пластинок, тогда в месте соприкосновения будут возникать разности потенциала, но так как система будет замкнутая, то в проводнике, соединяющем оба цинка, тока никакого не будет. Сколько бы мы ни взяли медных и цинковых пластинок, находящихся в непосредственном соприкосновении в жидкости, все равно в проводнике, соединяющем эту систему с отдельной цинковой пластинкой, тока не будет. Но стоит только в этой системе цинковые пластинки заменить какими-нибудь другими пластинками, тогда тотчас же возникнет электродвижущая сила и в проводнике появляется ток. Таким образом, если составить гальванический элемент, в котором одним электродом служит более окисляемый металл A, а другой электрод последовательно заменять Сплавы* его с металлом B и определять электровозбудительную силу такого элемента, то величина ее будет претеpпевать резкое изменение в тот момент, когда в Сплавы* появляется новый компонент. Если два металла относятся к первому типу, т. е. не дают ни соединения, ни изоморфной смеси, то Сплавы* их представляют простую механическую смесь взятых металлов и, следовательно, на основании предыдущего, электровозбудительная сила элемента, составленного из металла A (более окисляемого) и Сплавы* его с металлом B, должна быть равна нулю и только в том случае, когда вместо Сплавы* берут чистый металл B, она должна достигнуть некоторой величины. Примером таких Сплавы* могут служить Сплавы* кадмия и олова; разность потенциалов между кадмием и Сплавы* его с оловом, погруженными в раствор серно-кадмиевой соли CdSO 4, приведены в следующей таблице:
| Молекулярные проценты Cd: | Разность потенциалов, в милливольтах |
| 89,3 83,2 74,2 66,51 57,1 49,8 41,8 33,5 25,8 16,9 10,7 9,6 5,3 2,7 1,1 0,0 | 0,2 —0,2 —0,4 0,2 0,2 0,0 0,0 0,0 0,4 —0,4 —0,2 —0,2 —0,4 —2,6 137,6 163,0 |
Графически эти данные представлены на фиг. 6.
Фиг. 6. Фиг. 7. Фиг. 8.
Рассматривая эти цифры, мы видим, что разность потенциалов все время почти равна нулю, но, подходя к Сплавы* с малым содержанием Cd, она начинает непрерывно возрастать. Причину этого нетрудно разгадать: очевидно, при большом избытке олова один из компонентов исчезает, а другой начинает изменяться непрерывным образом, т. е. олово образует с кадмием твердый раствор ограниченной концентрации и, когда Сплавы* достигает этой концентрации, то он становится однородным и с увеличением содержания олова свойства его изменяются непрерывно, сообразно с этим и разность потенциалов начинает возрастать. Подобные исследования, произведенные над различными Сплавы*, доказали, что явления твердых растворов в Сплавы* весьма распространены и ускользают от наблюдения при других методах исследования только благодаря тому, что концентрация твердых растворов в большинстве случаев очень незначительна. Для практики это обстоятельство имеет огромное значение, так как в нем кроется причина громадных изменений свойствах металлов, от присутствия незначительного количества примесей. Известно, как сильно уменьшается электропроводность меди под влиянием примесей. Точно так же и механические свойства металлов сильно изменяются от самых ничтожных количеств посторонних тел. Робертс Аустен произвел обстоятельное исследование над изменением механических свойств золота под влиянием 0,2% различных примесей; результаты его исследований приведены в следующей таблице:
| Примеси | Количество примесей на 100 весовых частей золота | Сопротивление разрыву на 1 кв. мм, в килограммах. | Удлинение |
| K Bi Fe Pb Tl Sn Sb Cd
Ag Pd Zn Rh Mn In Cu Li Al | <0,2 0,210 0,186 0,240 0,193 0,196 0,203 0,203 0 0,200 0,205 0,205 0,210 0,207 0,290 0,193 0,201 0,186 | <0,8 0,80 6,11 6,57 9,78 9,78 9,45 10,83 11,03 11,18 11,18 11,88 12,22 12,58 12,58 12,95 13,97 13,97 | неизмеримо id. id. 4,9 8,6 12,3 ? 44,0 30,8 33,3 32,6 28,4 25,0 29,7 26,5 43,5 21,0 25,5 |
Не останавливаясь подробнее на этом вопросе, заметим только, что метод электровозбудительной силы является весьма чувствительным к обнаружению твердых растворов. В случае, если взятые металлы образуют соединение, состав его может легко быть определен с помощью метода электровозбудительной силы. В самом деле, пока Сплавы* содержит избыток металла A, разность потенциалов должна быть равна нулю. Как только Сплавы* перейдет определенное соединение, вместо компонентов A и Am Bn в Сплавы* появляются новые компоненты Am Bn и B и разность потенциалов должна претерпеть сразу сильное изменение. Определяя, в каких пределах состава происходит это изменение, легко можно установить формулу соединения. На фиг. 7 и 8 приведены кривые такого рода для Сплавы* Zn и Cu (латунь) и Sn и Cu (бронза). Если сравнить их с кривыми плавкости (фиг. 4 и 2), то можно видеть, что образование твердых растворов сказывается и здесь в виде непрерывной ветви.
Остается сказать еще несколько слов о самой постановке опыта: в действительности измеряют не электродвижущую силу элемента, а поляризацию его при пропускании через него некоторого постоянного тока. Под влиянием этого тока происходит электролиз соли более окисляемого металла A, в раствор которой погружаются металл A и Сплавы*, и металл A все время переносится со сплава на пластинку металла A. Таким образом, поверхность электродов остается все время без изменения и, благодаря этому, результаты получаются более постоянные. Самое измерение производится обычными способами. Мы не будем останавливаться на рассмотрении других физических методов для исследования Сплавы*, укажем только, что всякое физическое свойство, доступное измерению, может быть положено в основание для выработки метода; так, можно исследовать Сплавы* при помощи удельного веса, электропроводности, твердости, коэффициентов расширения и т. п. Каждый из этих методов имеет свои выгоды и невыгоды, но, вообще говоря, вывести правильные заключения с помощью одного какого-нибудь метода, в большинстве случаев, невозможно и необходимо производить исследование несколькими методами зараз.
Выводы о строении и природе Сплавы*, полученные при помощи различных методов, доступны непосредственной проверке при помощи микроскопа. Эти наблюдения, позволяющие непосредственно судить о микроструктуре Сплавы*, являются чрезвычайно веским подтверждением справедливости современного учения о природе Сплавы* Для изучения микроструктуры Сплавы* пользуются обыкновенными микроскопами, позволяющими достигать увеличения до 1000 раз, с тем только отличием, что микроскопы снабжаются особым осветителем, позволяющим производить наблюдение не в проходящем, а в отраженном свете. Это достигается при помощи небольшой призмы, помещенной на зрительной оси. Луч, падающий на призму, претерпевает полное внутреннее отражение и направляется на предмет, помещенный под объективом. Сплавы*, подвергаемый исследованию, отшлифовывается последовательно при помощи наждака различной крупности, наклеенного на бумагу, и окончательно отполировывается при помощи крокуса, натертого на сукно или замшу. Полученная таким образом поверхность должна быть блестяща, как зеркало, и не иметь штрихов, образующихся при шлифовании. Иногда при большом различии в твердости компонентов одной такой шлифовки уже достаточно для того, чтобы обнаружилась структура, но в большинстве случаев необходимо сделать так называемое вытравление. Вытравление производится при помощи какого-нибудь реагента, химически действующего на компоненты Сплавы* Выбор вытравителя производится так, чтобы он действовал на одну составляющую и не действовал на другую или, по крайней мере, действовал на них с неодинаковой силой. Обыкновенно употребляют кислоты HNO 3, HCl, H2SO4 — крепкие или разведенные, царскую водку, бромную или йодную воду и т. п. Более правильное вытравление производится при помощи слабого гальванического тока, который пропускают через Сплавы*, погруженный в раствор подходящего реагента. При этом со Сплавы* соединяют положительный полюс батареи (на котором выделяется кислотный радикал), а отрицательный соединяют с платиновой пластинкой, погруженной в ту же жидкость. Плотность тока должна быть не более 0,1 ампера на кв. стм вытравливаемой поверхности. Способ этот позволяет производить вытравление при помощи солей и дает возможность регулировать степень вытравления при помощи изменения силы тока и времени его действия. Шлифы Сплавы* очень мягких металлов, например свинцовых, оловянных, вместо шлифования, лучше приготовляются отливкой на полированную или гладкую поверхность, например, стали, слюды и т. п. и затем вытравляются обычным образом. Надлежаще вытравленный шлиф, помещенный в поле микроскопа, при увеличении в 150—300 раз, позволяет непосредственно рассмотреть структуру Сплавы*, в редких случаях приходится прибегать к более сильным увеличениям. К микроскопу можно присоединить фотографическую камеру.
МИКРОФОТОГРАФИИ СПЛАВОВ
1. Быстроохлажденный сплав сурьмы (39%) с медью (61%), представляющий твердый раствор Sb в SbCu 3. 2. Сплав (определенное соединение) сурьмы с платиной состава PtSb 2. 3. Определенное соединение сурьмы с медью SbCu 3. 4. Эвтектическая смесь олова (45%) и висмута (55%). 5 и 6. Эвтектические смеси меди и кадмия. 7. Сплав меди и кадмия с избытком компонента CuCd 2. 8. Сплав сурьмы и меди с избытком сурьмы. 9. Сплав сурьмы и меди с избытком меди. 10. Сплав меди (10%) и сурьмы (90%) — верхняя часть. 11. Тот же сплав — нижняя часть. 12. Тройной сплав свинца (21%), олова (5,5%) и висмута (74,5%).
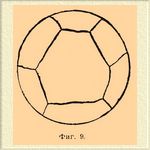
Подобные исследования показали, что строение Сплавы* находится в строгой зависимости от количественного состава Сплавы* и от характера взаимодействия компонентов его. Как уже указано было выше, полной однородностью Сплавы* будет обладать только в том случае, если металлы взяты в пропорции, отвечающей определенному соединению, или если компоненты дают изоморфную смесь или твердый раствор. В этом случае шлиф Сплавы* является совершенно однородным, состоящим из отдельных кристаллов, более или менее деформированных под влиянием давления, образующегося вследствие сжатия при охлаждении. Примеры подобной структуры можно видеть на фиг. 9, представляющей микрофотографию чистого золота, на фиг. 1 (табл.) — твердый раствор Sb в соединении сурьмы с медью SbCu 3.
Фиг. 9.
Фиг. 2 и 3 (табл.) дают микроструктуру определенных соединений PtSb 2 и SbCu 3. Как видно из этих рисунков, здесь, кроме кристаллических образований этих соединений, находится незначительное количество какого-то другого вещества; это происходит оттого, что состав Сплавы* не вполне точно отвечал формулам и избыток одного из металлов выделился в промежутках между зернами соединения. В том случае, когда Сплавы* неоднороден, строение его более сложно. Здесь надо различать два случая. 1) Компоненты не дают твердого раствора. В этом случае, как известно, температура Сплавы* непрерывно понижается, пока не достигнет эвтектической точки. Следовательно, здесь кристаллические выделения одного из компонентов должны быть окружены эвтектической смесью. Микрофотографии эвтектических смесей приведены на табл. фиг. 4 для Sn и Bi и фиг. 5 и 6 для Сплавы* Cu и Cd. В последнем случае компонентами являются Cu и определенное соединение CuCd 2. Характерной особенностью эвтектических смесей является отсутствие ясно выраженных кристаллов. Так как при затвердевании эвтектических смесей происходит одновременное выделение обоих компонентов, то условия для развития хороших кристаллов крайне неблагоприятны. Такой характер эвтектических смесей общ для всяких Сплавы* и они представляются или попеременно чередующимися слоями обоих компонентов (табл., фиг. 4 и 5), или же точечными выделениями одного компонента, окруженного слоями другого компонента (табл., фиг. 6). Если взять Сплавы* не отвечающий эвтектической точке, то строение его должно представиться в виде образований одного из компонентов, окруженных эвтектической смесью. Примеры подобной структуры можно видеть на табл. фиг. 7, представляющей микрофотографию Сплавы* Cu и Cd с избытком компонента CuCd 2, и фиг. 8 — отвечающей Сплавы* Sb и Cu с избытком сурьмы. 2) Один из компонентов образует твердый раствор. В этом случае эвтектическая точка будет отвечать твердому раствору наибольшей концентрации и микроструктура соответствующего Сплавы* представляет однородное поле, также как и Сплавы* содержащие избыток того компонента, который является растворителем в твердом растворе. При избытке же второго компонента структура Сплавы* представляется в виде кристаллических образований избытка этого компонента, окруженного однородным твердым раствором. Фиг. 9 таблицы представляет микрофотографию Сплавы* Sb и Cu, содержащего избыток меди.
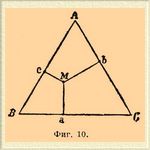
До сих пор мы рассматривали Сплавы* двух металлов. В случае трех металлов Сплавы* представляют подобные же явления и могут быть изучены теми же методами, но, разумеется, соотношения в них сложнее. Мы рассмотрим Сплавы* Pb, Sn и Bi. Графическое изображение температур плавления их уже не может быть представлено на плоскости, но должно быть отнесено к трем координатам. Для этого поступают следующим образом: в равностороннем треугольнике ABC (фиг. 10) сумма расстояний Ma+Mb+Mc какой-нибудь точки M от сторон треугольника есть величина постоянная, равная высоте треугольника. Если положить, что Ma+Mb+ Мс=100, то состав всякого Сплавы* может быть представлен какой-нибудь точкой внутри треугольника, причем Ma = процентному содержанию Pb, Mb — Sn и Mc — Bi.
Фиг. 10.
Если в каждой точке восстановлять перпендикуляр, пропорциональный температуре затвердевания Сплавы*, соответствующего взятой точке, то получится некоторая поверхность, которая выразит температуры затвердевания Сплавы* Поверхность эта имеет вид, представленный на фиг. 11.
Фиг. 11.
Ординаты, восстановленные в вершинах треугольника, выражают температуры плавления чистых металлов. Плоскости, имеющие основанием стороны треугольника, выражают температуры плавления двойных Сплавы*: Pb и Sn, Sn и Bi, Bi и Pb. Поверхность состоит из трех частей, отвечающих избытку каждого из трех компонентов. Эти части, пересекаясь попарно, дают по две кривые линии, отвечающие двойным эвтектическим смесям, а эти линии пересекаются в общей точке, отвечающей тройной эвтектической смеси. Затвердевание какого-нибудь тройного Сплавы* происходит таким образом, что сначала начинает выделяться тот компонент, который находится в избытке. По мере его выпадения жидкий Сплавы* будет приближаться к двойной эвтектической линии и когда достигнет ее, то начинает выделяться второй компонент; жидкий Сплавы* будет тогда приближаться к составу тройной эвтектической смеси и когда достигнет ее, то температура затвердевания будет оставаться без изменения, пока вся масса не затвердеет. Сообразно с таким механизмом затвердевания микроструктура Сплавы* будет представлять следующее: кристаллы избыточного компонента окружены двойной эвтектической смесью, которая в свою очередь будет окружена тройной эвтектической смесью. Фиг. 12 таблицы представляет микрофотографию такого тройного Сплавы*, содержащего 21% Pb, 5,5% Sn и 74,5% Bi, на которой ясно видны 3 последовательные фазы затвердевания.
Рассмотренное строение Сплавы* легко объясняет то явление, которое постоянно наблюдается при отливках и которое известно под названием ликвации. Сущность ликвации состоит в том, что различные части отлитой болванки имеют неодинаковый состав. Теперь сделалось очевидным, что все Сплавы* за исключением тех, строение которых вполне однородно, должны при затвердевании давать явление ликвации. Из неоднородных Сплавы* только те Сплавы*, состав которых отвечает эвтектической точке, не будут обнаруживать ликвации. Все же остальные Сплавы* при застывании выделяют кристаллы одного компонента, которые или тонут, или всплывают наверх, сообразно удельному весу; когда же жидкий Сплавы* достигнет эвтектической точки, то Сплавы* будет замерзать как однородное тело, хотя и является неоднородным. Само собой понятно, что чем ближе удельный вес жидкого Сплавы* и выделяющегося компонента, чем быстрее производится охлаждение и чем меньше расстояние между началом затвердевания и температурой затвердевания эвтектической смеси, тем менее ликвация будет давать различия в составе различных частей болванки. Фиг. 10 и 11 табл. представляют микроструктуру верхней и нижней части Сплавы* меди и сурьмы (10% Cu и 90% Sb), из которых процесс ликвации очевиден.
Нам остается рассмотреть еще химическую сторону Сплавы*, т. е. те соединения, которые дают металлы. Эти соединения совершенно подобны обычным химическим соединениям и во многих случаях по своим свойствам резко отличаются от свойств своих составных частей. Во многих случаях образование этих соединений сопровождается таким громадным выделением тепла, что реагирующая масса раскаляется до ярко-красного каления. Примером таких соединений могут служить амальгамы калия и натрия KHg 2 и NaHg 2, Сплавы* меди и алюминия Аl 2 Cu, платины и сурьмы PtSb 2. Реакции образования этих соединений по своей энергичности напоминают явление горения. Некоторые из металлических соединений имеют очень характерный цвет; так, соединение Al 2 Au пурпурного цвета, Cu 3 Sb — фиолетового. Что касается формы этих соединений, то на первый взгляд может показаться, что они не отвечают обычным эквивалентностям, но, по всей вероятности, это происходит оттого, что частицы этих соединений имеют более сложное строение, нежели то, которое представляют эмпирические формулы. Во всяком случае, уже теперь очень многие соединения можно разбить на несколько групп, в которых замещение одних металлов другими вполне согласно с периодической системой элементов (см.). Примером таких групп могут служить соединения типа бронзы RM 3, где M есть металл первой группы. Сюда относится обыкновенная бронза SnCu 3, сурьмяная бронза SbCu 3, серебряная бронза SbAg 3, соединение BiNa 3. Большую группу составляют соединения типа латуни R 2 M, где R есть металл второй группы, а M металл первой. Сюда относятся: обыкновенная латунь Zn 2 Cu, в котором Zn замещается Cd и дает Cd 2 Cu; замещая медь натрием, получим Cd 2 Na — соединение, хорошо изученное Курнаковым; замещая Cd ртутью, получим амальгамы Hg 2 Na и Hg 2 K; сюда же, вероятно, относятся и соединения Al 2 Au и Al 2 Cu. Соединение PtSb 2, по-видимому, относится к группе пирита FeS 2 и кристаллизуется также в правильной системе. При всех этих замещениях металлы, замещающие друг друга, или вполне эквивалентны, или же находятся в двух соседних группах (Sb и Sn, Al и Hg). Металлы, замещающие друг друга, соединяются между собой в отношении 1: 1, например, известны соединения SbSn и AlSb. Следующая таблица представляет попытку системы металлических соединений.
Тип бронзы RM3
M — металл первой группы; R — металл пятой группы, он может быть замещен металлом из четвертой группы:
| SbH3 | BiNa3 | |
| SbCu3 | (BiCu3) | SnCu3 |
| SbAg3 | (SnAg3) |
Тип латуни R2M
M — металл первой группы; R — металл второй группы, он может быть замещен металлом третьей группы:
| Zn2Cu | Cd2Cu | Al2Cu | |
| Cd2Na | Hg2Na | Al2Au | |
| Hg2K | |||
| Hg2Tl |
Тип RR' AlSb SnSb
Тип MM'
KTl (KNa) NaTl
В то же время, сопоставляя соединения какого-нибудь одноатомного металла с металлами других групп, получаем правильное возрастание числа атомов этого металла по мере увеличения кислотных свойств второго металла. Так, для натрия мы имеем хорошо изученный ряд:
NaHg2, NaTl, Na2Pb, Na3Bi.
Эти факты показывают, что соединения металлов между собой подчиняются тем же законам, что и обычные соединения, и недалеко время, когда они будут приведены в полное соответствие с периодической системой.
В заключение рассмотрим те превращения, которые происходят в уже затвердевших Сплавы* Опыт показывает, что свойства некоторых Сплавы* сильно изменяются в зависимости от того, насколько быстро произведено было охлаждение затвердевшего Сплавы* В связи с этим находится также и то обстоятельство, что, нагревая некоторые Сплавы* продолжительное время ниже температуры плавления, можно весьма сильно изменить свойства Сплавы* Шарпи произвел обширное исследование в этом направлении над Сплавы* меди и цинка и показал, что механические свойства этих Сплавы* сильно изменяются под влиянием продолжительного нагревания, причем микроструктура их совершенно изменяется. Робертс Аустен и Стансфильд, наблюдая охлаждение Сплавы* олова и меди (75% Cu) заметили, что между 500° и 600°, т. е. в то время, как Сплавы* уже сполна отвердел, происходит замедление скорости охлаждения, обусловленное, без сомнения, каким-то экзотермическим превращением, происходящим уже в твердом виде. Все эти факты показывают, что в Сплавы* могут происходить явления, аналогичные закалке стали. Исследование, произведенное над явлениями закаливания в Сплавы* меди и сурьмы, показали, что закалка в них обуславливается существованием двух полиморфных разновидностей соединения SbCu 4, из которых одна устойчива выше 400°, другая — при низших температурах. Переход одной разновидности в другую сопровождается выделением теплоты, вследствие чего при охлаждении этих Сплавы* наблюдается остановка пирометра при 400° Ц. Это явление совершенно аналогично явлению рекалесценции в стали. В связи с этим наблюдается и различие строения между закаленными и отпущенными Сплавы* Различие это обуславливается тем, что разновидность, стойкая выше 400° Ц., образует твердые растворы с Cu или Sb, которые при охлаждении распадаются с выделением этих металлов, так как вторая разновидность неспособна давать твердые растворы. Все эти факты приобретают особенный интерес вследствие того отношения, которое они могут иметь для разъяснения вопроса о закалке стали (см.).
Литература о Сплавы* сосредоточенна почти исключительно в периодических изданиях. Кроме специального журнала "The Metallographist", следует указать "Engineering" и "Bulletin de la Soci été d'encouragement pour l'Industrie nationale". В последних двух журналах помещаются отчеты и труды английского "Комитета для исследования Сплавы*" (Alloys Research Committee, осн. в 1890 г.) и французской "Комиссии Сплавы*" (Commission des alliages, осн. в 1896 г.). Наиболее выдающиеся труды принадлежат французским ученым Ле-Шателье, Шарпи, Готье и английским Робертсу Аустену, Гейкоку и Невилю; кроме того, следует упомянуть еще Осмонда. В 1900 г. по инициативе профессора Н. Сплавы* Курнакова основана русская Металлографическая комиссия для исследования Сплавы* при Императорском русском техническом обществе. Из русских работ по Сплавы* следует отметить статью Н. Сплавы* Курнакова: "О взаимных соединениях металлов"("Журнал Русского Физико-химического Общества", 1899). Из немецких укажем H. Behrens, "Das mikroskopische Gef ü ge der Metalle und Legierungen" и статью Гершковича: "Исследование металлических Сплавы*" ("Zeitschr. f. phys. Ch.", XXVII, 123; 1898). Из французских работ укажем; Le Chatelier, "Изучение Сплавы* при помощи измерения электровозбудительной силы" ("Bull. de la Soc. d'Encour.", 1895), "Об определенных соединениях в Сплавы*" (ib., 1895), "О плавкости металлических Сплавы*" (ib., 1895), "Металлографическая микроскопия" (ib., 1896), "Техника металлографической микроскопии" (ib., 1900), "О расширении Сплавы*" (ib., 1899); Charpy, "Исследование Сплавы* меди с цинком" (ib., 1896), "Микроскопические исследования Сплавы*" (ib., 1897), "Исследование белых антифрикционных Сплавы*" (ib., 1898), "О влиянии температуры на Сплавы*" (ib., 1899); H. Gautier, "Исследование плавкости металлических Сплавы*" (ib., 1896); Roberts Austen et Osmond, "Структура металлов" (ib., 1896).
А. А. Байков. Δ .
Технические сведения о составе употребительных Сплавы* см. в ст. Амальгама, Аргентан, Бронза, Гарт, Латунь, Ликвация, Мельхиор, Монетные сплавы, Сталь, Томпак, Ферроманган и при соответственных металлах, например Висмут, Золото, Марганец, Медь, Никель, Олово, Ртуть, Свинец, Серебро, Сурьма, Цинк и др.
|
Смотрии так же... |
|