Марганец, химический элемент
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| М | МИ | МА | МВ | МГ | МЕ | МЁ | МЗ | МИ | МК | МЛ | МН | МО | МП | МР | МС | МТ | МУ | МХ | МЦ | МШ | МЩ | МЫ | МЬ | МЭ | МЮ | МЯ |
| МАА |
| МАБ |
| МАВ |
| МАГ |
| МАД |
| МАЕ |
| МАЖ |
| МАЗ |
| МАИ |
| МАЙ |
| МАК |
| МАЛ |
| МАМ |
| МАН |
| МАО |
| МАП |
| МАР |
| МАС |
| МАТ |
| МАУ |
| МАФ |
| МАХ |
| МАЦ |
| МАЧ |
| МАШ |
| МАЩ |
| МАЮ |
| МАЯ |
Марганец, химический элемент (Manganè se — франц. и англ.; Mangan — нем.; Mn = 55,09 [Среднее из 55,16 (Dewar и Scott, 1883) и 55,02 (Marimac, 1884)]. Уже древние знали о существовании главной руды Марганец, пиролюзита, употребляли этот минерал при приготовлении стекла (Плиний Ст.) и уподобляли его магнитному железняку, хотя и знали, что он железа не притягивает. Шееле, в своей статье "De magnesia nigra" (1774), положил начало изучению M., а вместе с тем и хлора, кислорода и бария (в им исследованном материале присутствовала и ВаО). В том же году был получен и металлический Марганец Ганом. Кроме magnesia nigra существовало (XVI в.) название того же минерала — lapis manganensis; отсюда и ведет свое начало современное наименование металла. Соединения Марганец очень распространены в природе, но обыкновенно в малых количествах. Богатые металлом руды и минералы сдедующие: пиролюзит MnО 2, браунит Mn2O3, гаусманнит Mn3O4, псиломелан (Mn, Ва)О.MnО 2, манганит Mn2O2(OH)2, марганцевый шпат MnСО 3 обыкновенно в изоморфных смешениях (Mn,Fe)CO 3, (Mn,Ca,Mg)CO3, родонит MnSiO3. В малых количествах Марганец находится в большинстве силикатов, а потому присутствует в почвах, находится в золе растений и в костях животных. Встречается в виде сернистых соединений MnS и MnS 2, a также образует изоморфные смешения с другими сернистыми металлами. В самородном виде не встречается, потому что очень легко окисляется и труднее железа восстанавливается. Существует несколько путей для получения металлического Марганец: через восстановление углем окислов при сильном калении (John, Deville, Moissan), при сплавлении MnCl 2 с CaF 2 и металлич. Na (Brunner), путем электролиза крепкого раствора MnCl 2 (Bunsen). M. обыкновенно не получается чистым, содержит углерод, кремний. В чистом виде получают из амальгамы; амальгаму же можно получить, действуя амальгамой натрия на раствор MnCl 2, или электролизом того же раствора, употребляя катод из ртути; по полной отгонке ртути, что совершается при 440° (Moissan), остается порошкообразный металл. Водород и окись углерода более или менее легко действуют на многочисленные окислы Марганец, за исключением закиси MnО; ее они не восстанавливают даже при 600° (Wright и Luff), а потому все они водородом превращаются в MnО; последняя при сплавлении с металлическим алюминием, под известью и плавиковым шпатом, дает довольно чистый металл (до 97% — Greene и Wahl, 1893); при действии магния на сплав MnCl 2 + КСl 2 (1 в. ч. + 2 в. ч.) получается королек очень чистого металла (Glatzel, 1889), удел. вес которого, d 20°/20° = 7,3921. По цвету Марганец приближается к железу, но обладает красноватым отливом, подобно висмуту; ломок и очень тверд — режет сталь, стекло; совершенно не притягивается магнитом, если не содержит железа; теплоемкость 0,1217 (с содерж. Si, при 14° — 97°, Regnault); плавится труднее железа, при 1900°; по-видимому, летуч при температурах немного высших точки плавления [Как показали опыты нагревания до белого каления в фарфоровой трубке в струе окиси углерода, водорода или азота (Lorenz и Heusler, 1892). Ни с H, ни с CO не получается при этом летучего соединения, подобного NiC 4O4, как показало спектроскопическое исследование пламени H или СО, зажженных при выходе из трубки]. Марганец легко выделяет водород с разведенными кислотами, при чем получаются соли закиси MnХ 2; даже на подогретую воду он действует и окисляется при обыкновенной температуры на воздухе. Порошкообразный Марганец, из амальгамы, еще легче окисляется на воздухе и под водой; при взбалтывании его с водой и воздухом получается перекись водорода. Сплавы марганца с железом указаны ниже в ст. Марганец (металлургия), марганцевая сталь, ферроманган, белый чугун. Сплавы с медью очень похожи на сплавы олова с медью (см. Манганин). Сплав Марганец (80%) с цинком (5%) и медью (15%), так назыв. марганцевый нейзильбер, получается при восстановлении углем окислов, белого цвета, легко обрабатывается и хорошо полируется. О марганцовой бронзе см. Бронза. Из жидкой амальгамы отжиманием получена кристаллическая MnHg 5 [О. Prelingep (1893). Жидкая амальгама была получена, по Муассану, электролизом, по отгонке всей ртути в струе водорода при темно-красном калении остался серый пористый Марганец, уд. в. 7,4212, такой Марганец реагирует с азотной кислотой с воспламенением, из нашатырного раствора выделяет аммиак и водород, а также следующие металлы из их соляных растворов — Sn, Рb, Sb, As, Bi, Сr, Fe, Со, Ni, Сu, Zu и Cd]. Спектр Марганец дают искры от вторичной спирали, полученные на поверхности раствора MnCl 2, или свет дуги между электродами из металлического Марганец Спектр содержит много линий: в оранжевой части (3 л.), в синей (5 л.), в фиолетовой (2 л.). Спектр от MnO — полосчатый; источником служит огонь при бессемеровском процессе.
Кислородные соединение Марганец так многочисленны и разнообразны по свойствам, как ни для одного другого элемента; известны следующие — MnО, Mn 3O4, Mn2O3, MnО 2, MnО 3, Mn2O7. Состав высшего окисла определяет положение Марганец в 7-й группе периодической системы. Низший окисел есть основание; соли, отвечающие MnО, закиси, получаются при действии кислот и на металлический Марганец, и на все его окислы, при чем из высших выделяется лишний кислород
Mnn О m + 2nHX = nМnХ 2 + nН 2O + (m — n)O;
при употреблении соляной кислоты выделяется хлор:
Mnn О m + 2mHCl = nMnCl2 + mH2O + (m — n)C12.
При обыкн. темп. могут существовать все окислы, при нагревании постоянен один — Mn 3O4; при нагревании на паяльной лампе в тигле при доступе воздуха МnО поглощает кислород, а МnО 2 теряет его, также и Мn 2 О 3 — в обоих случаях образуется Мn 3 О 4, а потому при количественном анализе применяется взвешивание в виде этого окисла; высшие окислы МnО 3 и Мn 2 О 7 в свободном виде очень непостоянны, даже при обыкн. темп. Основные свойства МnО очень значительны; по мере накопления кислорода основные свойства слабеют, но они могут быть подмечены даже для Мn 2 О 7; с другой стороны, МnО 2, будучи основанием крайне слабым, проявляет уже свойства слабого кислотного окисла; ангидридные свойства МnО 3 и особенно Мn 2 О 7 вполне резко выражены.
Закись Марганец удобнее всего получается при нагревании в струе водорода высших окислов или углекислого Марганец в виде зеленоватого порошка; она превращается в прозрачные, зеленые, блестящие октаэдры, если водород, в котором ее нагревают, содержит некоторое количество хлористого водорода; эти кристаллы, не изменяя формы, превращаются в Мn 3 О 4 при нагревании на воздухе. Гидрат закиси Мn(ОН) 2 осаждается щелочами из растворов солей закиси в виде белого осадка, быстро буреющего на воздухе вследствие окисления. По химическим свойствам МnО очень походит на MgO; основные свойства МnО резче; соли МnХ 2 сходны то с солями MgX 2, то с солями FeX 2, NiX2, CuX2. Хлористый Марганец (безводный) MnCl 2 получается при прямом соединении Марганец и хлора, при нагревании в токе хлористого водорода МnО или МnСО 3; представляет светло-розовые кристаллические листочки, при красном калении плавится и при действии влажного воздуха дает НСl и высшие окислы Марганец В растворе MnCl 2 получают обыкновенно из остатков от добычи хлора; здесь всегда находится FeCl 3, которое с МnСО 3 дает MnCl 2, a Fe(OH)3 осаждается; иной раз в исходном растворе присутствуют еще соли меди, бария или кальция, тогда сероводородом удаляют медь, а сернистым аммонием осаждают весь Марганец в виде тельно-розового осадка MnS, растворимого легко в соляной кислоте. Если кристаллизация из крепкого раствора MnCl 2 совершается при 15-20°, то осаждаются кристаллы одноклин. сист. состава MnCl 2.4H2 O; чтобы обезводить эту соль нужно нагревать в токе HCl-газа. МnВr 2.4H2 O вполне похож на предыдущую соль; MnJ 2.4H2 O в отсутствии воздуха может быть обезвожен и даже расплавлен, в присутствии воздуха нагревание приводит к выделению паров йода, причем получаются окислы Марганец Сернокислый MnSO4 получается при сильном нагревании тестообразной смеси пиролюзита и крепкой серной кислоты, при чем происходит выделение кислорода. По охлаждении — извлечение водой и кристаллизация; из крепкого раствора ниже 6° выделяются кристаллы MnSO 4.7H2 O, изоморфные с железным купоросом, при 7° -20° — кристаллы MnSO 4.5H2 O, изоморфные с медным купоросом; известны также гидраты и другого состава. Ниже 200° все эти гидраты дают MnSO 4.H2 O (Грэм) — желтовато-розоватый порошок; этот гидрат теряет воду выше 200°, при чем теряет и окраску, разлагается только при красном калении, превращаясь в Mn 3O4. Двойные соли, как при других купоросах, имеют состав M 2Mn(SO4)2.6H2O. Азотнокислый Марганец, Мn(NO 3)2.6H2O, при нагревании плавится, кипит при 129,5°, разлагаясь и выделяя черную окись Mn 2O3. Углекислый Марганец, 5MnCO3.Mn(OH)2 (H. Rose), получается в виде белого осадка при действии соды на растворы МnХ 2; он очень трудно растворим в воде (1 ч. в 8000), а потому применяется при количественном анализе для отделения; уже при обыкн. темп. осадок окисляется, а при накаливании дает красную Mn 3O4. При действии на раствор солей MnХ 2 цианистым калием получается желтоватый осадок синеродистого Марганец, MnСу 2, который очень непостоянен. Подобно желтой соли (см.), и здесь имеется двойная соль К 4 МnСу 6.3H2 O, кристаллизующаяся в виде темно-сине-фиолетовых квадратных пластинок; они легко теряют воду и дают раствор, к удивлению, почти не окрашенный или слабо-желтый. При стоянии на воздухе такого раствора совершается окисление
2K4MnCy6 + H2 O + О = 2К 3 MnСу 6 + 2КОН;
получается новая соль, аналогично превращению желтой соли в соль Гмелина (см.) но там для этой реакции требуется энергический окислитель, здесь же она совершается очень легко, при действии кислорода воздуха. Эта двойная соль К 3 МnСу 6, относящаяся к окисному типу — МnХ 3, кристаллизуется в виде темно-красных призм; при действии амальгамы калия с водой она восстанавливается в предыдущую.
Двуокись Марганец МnО 2 [Ниже будут рассмотрены соединения окисного типа: но сначала должно сказать о МnО 2, неправильно именуемой "перекисью" Этот окисел не есть перекись свинца, это суть двуокиси, металл в них четырехэквивалентен; их структурные формулы такие 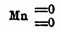 и
и  , с кислотами они не дают перекиси водорода, хотя последняя в присутствии аммиака и осаждает из раствора МnХ 2 двуокись; состав осадка Mn 6O11=5MnO2 MnO (A. Carnot)], подобно РbО 2, обладает слабыми кислотными свойствами, а потому образует с основаниями солеподобные соединения, манганиты. Важнейшая руда. Марганец, пиролюзит, есть почти чистая двуокись, встречается в виде квадратных кристаллов и в виде масс, кристаллического характера; обладает стально-серым или черным цветом и металлическим блеском, уд. в. 4,82. Из солеподобных соединений в природе находятся псиломелан — (Мn, Ва)О.2МnО 2, манганит Мn 2O2 (ОН) 2, который можно представить чрез МnО. МnО 2.H2 O [В природе встречается обыкновенно вместе с известковым и тяжелым шпатом]. Искусственно МnО 2 можно получить, если промыть азотной кислотой, при кипячении, остаток после слабого каления Mn(NO 3)2 или MnСО 3 при доступе воздуха; в первом случае промывается черная окись Mn 2O3, во втором — красная закись-окись Mn 3O4 (см. ниже); так как в обоих случаях остается до промывании двуокись, то и Mn 2O3, и Mn 3O4 должно считать солеподоб. веществами, как Pb 2O3 и Pb 3O4 (сурик), которые точно так же при действии HNO 3 дают PbO 2. Двуокись Марганец можно получить и в виде гидрата, если действовать на раствор MnХ 2 раствором хлора или брома в едкой щелочи или если промыть гидрат Mn 2O3 азотной кислотой; такой гидрат MnО 2, промытый водой, растворим с бурым цветом (Gorgen); раствор обладает кислой реакцией, сохраняется в течение недель; малые количества щелочей или кислот осаждают гидрат (свертывают) [Получены след. калиевые соли этой кислоты: K 2O.5MnO2 — желтый осадок, образующийся при действии углекислоты на раствор K 2MnO4; K2O.MnO2 — темно-бурый порошок, получается при нагревании KMnО 4, второй манганит водой разлагается на КОН и первый манганит]. Но двуокись Марганец обладает и свойствами основными; если действовать при охлаждении на MnO 2, разболтанную в эфире, хлористым водородом, то получается зеленый раствор, по всей вероятности MnCl 4 (аналогично действуют и НВк и HJ); при -26° MnCl 4 почти не разлагается в водном растворе (Vernon, 1892); с крепкой плавиковой кислотой получается из MnО 2 несомненно MnF 4, потому что бурый раствор, получающийся при этом с KF, дает розовый осадок состава K 2MnF6. Если смешать 1 часть марганцево-кислого калия (см. ниже) с 5 ч. Н 2 SО 4 и 1 1/2 ч. H 2 O, то по мере выделения кислорода раствор делается желтым; из этого раствора вода осаждает гидрат Mn(OH) 4, a MnSO4 — двойную соль Mn(SO 4)2.MnSO4.9Н 2 O, в виде шестиугольных табличек, растворимых в слабой серной кислоте с красным цветом. С давних пор, как выше упомянуто, пиролюзит употребляется при выделке стекла, именно для уничтожения зеленого цвета, что, вероятно, происходит вследствие окисляющего действия MnО 2 на закись железа, а потому этот минерал получил название "мыла стеклоделов", действующего на огне (πυρ — огонь, λύω — мою). Очень важное значение пиролюзит имеет для добычи хлора, потому что уже при слабом нагревании с соляной кислотой или с поваренной солью и разведенной серной кислотой идет реакция
, с кислотами они не дают перекиси водорода, хотя последняя в присутствии аммиака и осаждает из раствора МnХ 2 двуокись; состав осадка Mn 6O11=5MnO2 MnO (A. Carnot)], подобно РbО 2, обладает слабыми кислотными свойствами, а потому образует с основаниями солеподобные соединения, манганиты. Важнейшая руда. Марганец, пиролюзит, есть почти чистая двуокись, встречается в виде квадратных кристаллов и в виде масс, кристаллического характера; обладает стально-серым или черным цветом и металлическим блеском, уд. в. 4,82. Из солеподобных соединений в природе находятся псиломелан — (Мn, Ва)О.2МnО 2, манганит Мn 2O2 (ОН) 2, который можно представить чрез МnО. МnО 2.H2 O [В природе встречается обыкновенно вместе с известковым и тяжелым шпатом]. Искусственно МnО 2 можно получить, если промыть азотной кислотой, при кипячении, остаток после слабого каления Mn(NO 3)2 или MnСО 3 при доступе воздуха; в первом случае промывается черная окись Mn 2O3, во втором — красная закись-окись Mn 3O4 (см. ниже); так как в обоих случаях остается до промывании двуокись, то и Mn 2O3, и Mn 3O4 должно считать солеподоб. веществами, как Pb 2O3 и Pb 3O4 (сурик), которые точно так же при действии HNO 3 дают PbO 2. Двуокись Марганец можно получить и в виде гидрата, если действовать на раствор MnХ 2 раствором хлора или брома в едкой щелочи или если промыть гидрат Mn 2O3 азотной кислотой; такой гидрат MnО 2, промытый водой, растворим с бурым цветом (Gorgen); раствор обладает кислой реакцией, сохраняется в течение недель; малые количества щелочей или кислот осаждают гидрат (свертывают) [Получены след. калиевые соли этой кислоты: K 2O.5MnO2 — желтый осадок, образующийся при действии углекислоты на раствор K 2MnO4; K2O.MnO2 — темно-бурый порошок, получается при нагревании KMnО 4, второй манганит водой разлагается на КОН и первый манганит]. Но двуокись Марганец обладает и свойствами основными; если действовать при охлаждении на MnO 2, разболтанную в эфире, хлористым водородом, то получается зеленый раствор, по всей вероятности MnCl 4 (аналогично действуют и НВк и HJ); при -26° MnCl 4 почти не разлагается в водном растворе (Vernon, 1892); с крепкой плавиковой кислотой получается из MnО 2 несомненно MnF 4, потому что бурый раствор, получающийся при этом с KF, дает розовый осадок состава K 2MnF6. Если смешать 1 часть марганцево-кислого калия (см. ниже) с 5 ч. Н 2 SО 4 и 1 1/2 ч. H 2 O, то по мере выделения кислорода раствор делается желтым; из этого раствора вода осаждает гидрат Mn(OH) 4, a MnSO4 — двойную соль Mn(SO 4)2.MnSO4.9Н 2 O, в виде шестиугольных табличек, растворимых в слабой серной кислоте с красным цветом. С давних пор, как выше упомянуто, пиролюзит употребляется при выделке стекла, именно для уничтожения зеленого цвета, что, вероятно, происходит вследствие окисляющего действия MnО 2 на закись железа, а потому этот минерал получил название "мыла стеклоделов", действующего на огне (πυρ — огонь, λύω — мою). Очень важное значение пиролюзит имеет для добычи хлора, потому что уже при слабом нагревании с соляной кислотой или с поваренной солью и разведенной серной кислотой идет реакция
MnО 2 + 4НСl = MnСl 2 + 2Н 2 O + Сl 2.
Довольно давно возникла мысль превращать MnО, находящуюся в остатках после добывания хлора, опять в MnO 2. С 1867 г. часто применяется следующий путь (Walter Weldon): кислая жидкость нейтрализуется углекислой известью, при чем осаждается окись железа; прозрачный раствор смешивают с известковым молоком, нагревают паром и вдувают сильную струю воздуха; в этих условиях, вероятно, благодаря присутствии извести, MnО окисляется до MnО 2, которая и получается затем в осадке и может быть снова пущена в дело.
Окись Марганец, Mn2O3, и соли типа MnХ 3. Выше указано, что окисел этого типа с азотной кислотой дает MnO 2: последняя извлекает из него MnО. Но Mn 2O3 имеет и самостоятельное значение, подобно Аl 2O3, Fe2O3. В природе Mn 2O3 представляет минерал браунит (см.); искусственно получается при накаливании всякого другого окисла Марганец в струе кислорода или смеси его с азотом, но содержащей более 26% кислорода, в виде черного порошка, уд. веса 4,32. Соответственные соли MnCl 3 и Mn 2(SO4)3 известны только в растворах и легко разлагаются с выделением Cl или О, но двойные соли сравнительно прочны: например квасцы K 2Mn2(SO4)4.24Н 2 O, которые образуют фиолетовые октаэдры, фиолетово-красные кристаллы (NH 4)2MnCl5 и К 2 MnСl 5 (Neumann), а также вышеупомянутая двойная соль, аналогичная красной соли Гмелина, К 3 MnСу 6. Квасцы водой разлагаются с образованием гидрата окиси Mn 2O2 (ОН) 2. Этот гидрат встречается, как упомянуто, и в природе под именем манганита, в виде стально-серых или черных квадратных кристаллов, уд. веса 4,3; он очень похож на пиролюзит, но черта, проведенная на неглазурованном фарфоре от пиролюзита — черная, а от манганита — бурая.
Закись-окись Марганец Mn3O4, или красная окись, встречается в бурых ромбических пирамидах под названием гаусманнита, уд. вес которого 4,85. Этот окисел получается при прокаливании на воздухе всех окислов Марганец в виде красно-бурого порошка, уд. веса 4,72; она превращается в кристаллы гаусманнита при нагревании в слабом токе НСl. В холодной крепкой серной кислоте Mn 3O4 растворяется с красным цветом, превращаясь в Mn 2(SO4)3 и MnSO 4, а при нагревании с разведенной серной кислотой дает 2MnSO 4 и MnО 2, так же и при действии кипящей азотной кислоты (см. выше).
Марганцовистый и марганцевый ангидриды, MnО 3 и Mn 2O7. Глаубер (1659) уже сообщает, что при сплавлении пиролюзита с едкой щелочью получается масса, растворяющаяся в воде с пурпуровым цветом, который превращается затем в зеленый. В сочинении неизвестного автора "Ключ к тайному кабинету сокровищницы природы" (1705) говорится о подобном же сплаве, который растворяется, однако, с серо-зеленым цветом; цвет раствора делается затем небесно-голубым, фиолетовым и наконец красным. Шееле дал продукту сплавления название "минерального хамелеона". Сущность дела уяснена Э. Митчерлихом. Не только двуокись, но и низшие окислы при сплавлении со щелочью дают зеленый продукт, при чем совершается поглощение кислорода из воздуха; прибавление селитры способствует превращению; здесь образуется зеленая соль состава К 2 MnО 4; раствор ее при избытке щелочи постоянен и обладает тем же цветом. Если нейтрализовать часть щелочи кислотой, то цвет раствора меняется в фиолетовый и красный, вследствие превращения в др. соль
3К 2 MnО 4 + 2Н 2 O = 2КMnО 4 + 4КОН + MnО 2;
это превращение совершается и при содействии углекислоты, и при простом разбавлении водой, при чем раствор мутится, вследствие осаждения двуокиси. КMnО 4 есть марганцево-, а К 2 MnО 4 марганцовисто-кислый калий. Если кипятить КMnО 4 в крепком щелочном растворе, то идет обратное превращение при выделении кислорода
4КMnО 4 + 4КOH = 4K 2 MnО 4 + 2Н 2 O + О 2;
прибавление веществ, способных окисляться (напр. спирта), способствует превращению; так же действует и органического происхождения пыль, попадая из воздуха в щелочной раствор КMnО 4. Na2MnO4.10H2 О походит на глауберову соль, а ВаMnО 4 не растворим в воде (подобно BaSO 4) и кислотами разлагается. Соответственная кислота Н 2 MnО 4 неизвестна, а ангидрид MnО 3 представляет собой (Thorpe) аморфную расплывчатую красноватую массу, кажущуюся в отраженном свете почти черной. Если к хорошо охлажденной крепкой серной кислоте прибавлять постепенно KMnO 4, то получается зеленый раствор, а на дне собирается темно-красно-бурая жидкость, не застывающая при -20° и очень непостоянная; это марганцевый ангидрид MnO 7, при нагревании взрывающий [При чем появляется даже огонь; то же происходит при соприкосновении с бумагой и другими органическими веществами или если бросить одну каплю в сосуд, содержащий пары спирта, эфира, сероводорода и проч.] и растворяющийся в воде с разогреванием; получающийся при этом красный раствор содержит кислоту НMnО 4. Упомянутый зеленый сернокислый раствор, образующийся над слоем Mn 2O7, содержит, вероятно, вещество состава (Mn 2O6)SO4. Если к такому раствору прибавлять осторожно, при охлаждении, плавленой поваренной соли, то выделяется марганцевый хлорангидрид MnO 3 Cl (Ascboff), по уравн.:
(Mn2O6)SO4 + 2NaCl = Na2SO4 + 2MnO З Cl
в виде желтого газа, сгущающегося в охладительной смеси в зеленовато-бурую жидкость, обладающую свойствами хлорангидридов и взрывающую при нагревании. Из того же зеленого раствора был получен (Thorpe) марганцовистый ангидрид; при медленном прибавлении раствора к безводной соде по ур.:
(Mn2O6)SO4 + Na2CO3 = MnO3 + Na2SO4 + CO2 + O
ангидрид в виде порошка уносился током газов (СО 2 и О) и собирался в трубке, наполненной битым стеклом. Обыкновенный препарат из этой группы соединений есть KMnO 4, который часто называют "хамелеоном". В совершенно чистом виде он может быть получен (Грегори) так: возможно крепкий раствор 10 ч. КОН смешивают с 7 ч. КСlО 3 и 8 ч. MnО 2, выпаривают досуха и остаток нагревают при темно-красном калении до полного разложения КСlО 3; темно-зеленая масса извлекается водой; отстоявшийся раствор фильтруется через асбест и подвергается кристаллизации; выделяются длинные призмы КMnО 4, изоморфные с КСlО 4. Хамелеон растворим в 15 частях холодной воды; раствор обладает густым пурпуровым цветом. В химической практике хамелеон является окислителем; окисления совершаются особенно легко в присутствии избытка разведенной серной кислоты. Смесь хамелеона с серой взрывает при ударе, смесь с порошкообразным магнием горит очень быстро (см. Магний); раствор КMnО 4 употребляется при очищении водорода (для окисления AsH 3 и пр. примесей), как реактив для окисления органических соединений (Е. Е. Вагнер). В присутствии серной кислоты окислителем является, очевидно, свободная кислота НMnО 4. Относительно применения окислительной способности хамелеона в объемном анализе см. в ст. Железо (анализ), Окислы азота, Оксидиметрия. Хамелеон употребляется при определении азота в органических соединениях, по Кьельдалю, для того, чтобы закончить окисление органического вещества, начатое крепкой серной кислотой; азот здесь при избытке кислоты получается в виде серноаммиачной соли; свободный аммиак хамелеоном окисляется. Фабричное производство солей марганцевой и марганцовистой кислот развилось со времени применения их для дезинфекции (Hofmann, 1859), для чего готовят менее чистые натриевые препараты.
Из других соединений Марганец должно упомянуть о соединениях с серой и азотом. Сернистый M., MnS, находится в природе в виде марганцевого блеска, стально-серой массы или кристаллов (кубов), уд. в. 4,04; искусственно получают при накаливании в токе H 2 S закиси или ее солей; из растворов MnХ 2 сернистый аммоний осаждает тельно-розовый осадок, буреющий на воздухе, при нагревании под раствором превращающийся в зеленый гидрат 3MnS.Н 2 O. Минерал гауэрит, MnS2, большие буро-черные октаэдры; отвечает по составу двуокиси; при нагревании MnSO 4 с раствором многосернистого калия при 160-180° в запаянной трубке получается кирпично-красный порошок того же состава. Два соединения с азотом, Mn5N2 и Mn 3N2 получены недавно (О. Prelinger) и представляют твердые вещества уд. веса 6,58 и 6,21, обладающие металлическим блеском; первое получается при накаливании в струе азота, а второе в струе аммиака — металлического Марганец из электролизом полученной амальгамы; можно и не выделять предварительно металл из амальгамы, а прямо ею пользоваться. Если нагревать в струе азота амальгаму, то, когда отгонка ртути оканчивается, замечается значительное разогревание трубки, в которой производится операция. M n3N2 при прокаливании в струе азота превращается в Mn 5N2 , а это соединение в струе аммиака дает вновь Mn 3N2. Mn5N2 при нагревании в струе водорода дает аммиак, а также и при действии щелочей и даже воды; химические отношения Mn 3N2 таковы же.
При систематическом анализе соляных смесей, Марганец, по осаждении углекислым барием гидратов окисей типа R 2O3, оказывается в растворе вместе с цинком; по осаждении сернистым аммонием его извлекают из осадка уксусной кислотой, которая не растворяет ZnS; из раствора, не содержащего других металлов, Марганец осаждают содой и взвешивают в виде Mn 3O4. При сокращенных способах отделения Марганец оказывается нередко с магнием, подобно которому он трудно осаждается в присутствии аммиачных солей; отделение в таких случаях основывается на переводе MnХ 2 в MnO 2, действием галоида в щелочном растворе. Техническое испытание марганцевых руд и препаратов нередко сводится к определению в них кислорода, способного выделять хлор с соляной кислотой; отвешенное количество испытуемого материала обрабатывают соляной кислотой, улавливают хлор раствором KJ и определяют йод, сделавшийся свободным (см. Йодометрия).
С. С. Колотов, Δ .
|
Смотрии так же... |
|