Медь
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| М | МИ | МА | МВ | МГ | МЕ | МЁ | МЗ | МИ | МК | МЛ | МН | МО | МП | МР | МС | МТ | МУ | МХ | МЦ | МШ | МЩ | МЫ | МЬ | МЭ | МЮ | МЯ |
| МЕА |
| МЕБ |
| МЕВ |
| МЕГ |
| МЕД |
| МЕЕ |
| МЕЖ |
| МЕЗ |
| МЕИ |
| МЕЙ |
| МЕК |
| МЕЛ |
| МЕМ |
| МЕН |
| МЕО |
| МЕП |
| МЕР |
| МЕС |
| МЕТ |
| МЕУ |
| МЕФ |
| МЕХ |
| МЕЦ |
| МЕЧ |
| МЕШ |
| МЕЩ |
Медь (хим.) Сu (от лат. Cuprum), атомный вес около 63,3. — По некоторым археологическим данным Медь была хорошо известна египтянам еще за 4000 лет до Р. Х. Знакомство человечества с Медь относится к более ранней эпохе, чем с железом; это объясняется, с одной стороны, более частым нахождением Медь в свободном состоянии на поверхности земли, а с другой — сравнительной легкостью получения ее из соединений. Древняя Греция и Рим получали Медь с о-ва Кипра (Cyprum), откуда и название ее Cuprum. Медь в значительной степени распространена в природе. В свободном состоянии она встречается в россыпях; попадаются самородки Медь до 430 тонн весом. Из соединений Медь в природе распространены, главным образом, сернистые, содержащие, кроме Медь, обыкновенно Fe, Ag, As, Sb, напр. медный блеск Сu 2 S, медный колчедан, халькопирит CuFeS 2, пестрая медная руда Cu 3FeS3, CuAgS и пр. Из кислородных соединений встречаются Сu 2 O — куприт (красная медная руда), CuO — черная медная руда; кроме того, встречаются различные медные соли: угольной кислоты, напр. малахит СuСО 3 Cu(НО) 2, медная лазурь 2СuСО 3.Сu(HО) 2; серно-кислые, напр. CuSO 4 + 5H2 O; силикаты, напр. CuSiO 3 + 2H2 O — хризоколь, CuSiO 3 + Н 2 O — диоптаз; мышьяковые соли, напр. 4CuO.2As 2O5 — оливенит, фосфаты и пр. Вода некоторых минеральных источников содержит в растворе медные соли, напр. Теплиц, Висбаден и пр. Медь встречается в золе некоторых растений, напр. в табаке; наконец, ее находят в метеоритах.
Физические свойства М. Присутствие ничтожных следов примесей сильно изменяет свойства Медь, и этим объясняется различие относящихся сюда данных. В отраженном свете Медь ярко-красного цвета, в очень тонких листочках она просвечивает зеленым цветом. Кристаллизуется Медь в формах правильной системы, обыкновенно в виде кубов. Удельный вес ее сильно меняется в зависимости от происхождения и обработки, например (при обыкновенной температуре) для природных кристаллов Медь он равен — 8,94; для Медь, гальванопластически осажденной — 8,91; для Медь плавленной — 8,921; кованой — 8,952. Сравнительно небольшой удельный вес плавленной Медь объясняется способностью ее в жидком состоянии поглощать газы, которые, выделяясь при затвердевании, делают массу пористой; проковкой эти поры уменьшаются. Температура плавления дается разная — от 1330° до 1050°, последняя наиболее вероятна. Коэффициент расширения (линейный) ок. 0,000018; кубический — 0, 0000565 — 0,0000518 (Копп). Теплоемкость Медь (от 0° до 100°), по Реньо — 0,09515 — 0,9332 (Томлинсон), от 0° до 360° — 0,104 (Леверье), Медь в слабой степени диамагнитна. Электропроводность Медь твердой 99,95; мягкой 102,21 (для серебра 100). Тягучесть и ковкость ее сильно зависят от примесей. После железа — это наиболее вязкий металл. Для разрыва проволоки 1 кв. мм сечения принимается груз 45 — 60 кг. По ковкости она лежит между серебром и оловом. Спектр Медь имеет ярко-зеленые линии с длиной волны 5107, 5153, 5 2 17; для получения его лучше всего делать разряд между медными электродами, так как спектр медных солей, например хлористой, бромистой Медь и пр. усложняется присутствием галоида и получается несколько иной.
Химические свойства. Медь при обыкновенной температуре и в сухом воздухе не изменяется; во влажном воздухе она покрывается слоем окислов, которые с СО 2 образуют углекислые соли. При нагревании на воздухе, в зависимости от количества последнего и температуры, Медь дает окись CuO или закись Cu 2 O. Воды Медь не разлагает ни при какой температуре и из кислородных кислот не выделяет водорода. Растворение Медь в этих кислотах или требует присутствия кислорода воздуха, или идет в две фазы; в первой фазе Медь окисляется за счет кислорода кислоты, причем выделяются различные продукты восстановления последней; во второй фазе образовавшийся окисел Медь с избытком кислоты дает соль. Крепкая азотная кислота делает Медь пассивной, подобно железу, слабая растворяет с выделением окиси азота, напр. 3Cu+8HNO 3=3Cu(NO З)2 +2NO+4Н 2 O (ср. соотв. статью). При растворении Медь в серной кислоте происходит сложная реакция. По Пиккерингу, кроме главной реакции Cu+2H 2SO4=CuSO4+SO2+2H2 O раскисление идет еще дальше, и сернистого газа не получается, а выделяется полусернистая Медь: 5Cu+4H 2SO4=3CuSO4+Cu2S+4H2O. Последняя реакция идет тем лучше, чем ниже температура. При нагревании Cu 2 S может растворяться в H 2SO4, причем выделяется сера и водород. Соляная кислота растворяет Медь при нагревании с выделением водорода. То же производит и крепкая йодисто-водородная. Растворы солей, в особенности аммиачных, более или менее действуют на Медь Водный аммиак в присутствии кислорода растворяет Медь; полученный раствор обладает способностью растворять клетчатку. Медь прямо соединяется с хлором, бромом, йодом, серой и пр. В сухом хлоре тонкий листочек Медь воспламеняется при обыкновенной температуре. Медь с другими металлами образует многочисленные сплавы и со ртутью дает легко амальгаму. Многие из сплавов Медь, например с цинком, оловом, свинцом, серебром, золотом, алюминием имеют громадное значение для техники (см. Бронза, Латунь, Монетные сплавы, Мельхиор, Томпак и пр.). Для получения чистой Медь или выделяют ее электролитическим путем, или восстановляют водородом из окиси.
Соединения М. Для Медь известны, главным образом, два вида соединений: CuX — соединения закисные и СuХ 2 — окисные (X — одноатомный элемент или одноатомная группа). Занимая в периодической системе место в одном ряду с золотом и серебром, Медь представляет с ними много общего в характере соединений; в особенности закисные соединения Медь представляют много общего с соединениями окиси серебра, например природная Cu 2 S — изоморфна с Ag 2 S, CuCl, подобно AgCl, не растворима в воде и растворяется в аммиаке; CuJ сходно с AgJ по нерастворимости в воде и плохой растворимости в NH 3; Cu2SO4 подобно Ag 2SO4 плохо растворима в воде и пр. С водородом Медь дает Cu 2 Н 2 — водородистую Медь Она получена Вюрцем при восстановлении медного купороса фосфорноватистой кислотой при нагревании. Cu 2 Н 2 — вещество бурого цвета, во влажном виде постоянно на холоде, разлагается при 55°; с НCl оно выделяет водород: Cu 2 Н 2+2HCl=Cu2Cl2+2H2; в хлоре воспламеняется. Поггендорф указывает на образование водородистой Медь при электролизе медного купороса слабым током, а Шютценбергер при восстановлении его сернисто-кислым натрием. С кислородом известно несколько соединений Медь Cu 4 О, Cu 2 О, CuО, CuО 2. Квадратная окись Медь Cu 4 О получается при восстановлении гидрата окиси M. Cu(HО) 2 хлористым оловом в щелочном растворе, представляет вещество малопрочное, на воздухе легко окисляется, соответственных солей не образует и при растворении в кислотах дает соли закиси или окиси Медь с выделением металлической Медь, например: Cu 4 О+2НСl=Сu 2Cl2 +2Сu+Н 2 O. Закись M. Cu 2 О встречается в природе в виде октаэдров или кубов красного цвета (куприт). Для получения еe существует много способов. Она получается при прокаливании окиси Медь CuО с металлической M.: CuO+Cu=Cu 2 О или полухлористой M. Cu 2 Сl 2 с содой, по уравнению: Cu 2 Сl 2+Na2CO3=Cu2O+2Na2 Сl+CO 2 и в особенности при раскислении солей окиси Медь в присутствии различных органических веществ в щелочном растворе. Удобнее всего поступать так: к медному купоросу прибавляют достаточное количество винной кислоты и избыток щелочи (образуется двойная соль, растворимая в щелочи), кладут затем патоку и нагревают. Сначала выделяется малоизвестный гидрат закиси, который переходит в Cu 2 O. Она получается также прямо при продолжительном кипячении муравьиной или уксусной соли Медь и пр. Закись Медь на воздухе постоянна, она растворяется в NH 3 и дает бесцветный раствор, легко окисляющийся и при этом синеющий; при сплавлении она окрашивает стекло, буру, фосфорно-натриевую соль в красный цвет, что служит для качественного распознавания Медь Закиси Медь соответствуют соли, которые вообще бесцветны, легко окисляются и пр. Наибольшую практическую важность из кислородных соединений представляет окись Медь CuO, которая играет большую роль при органическом анализе. Она получается при прокаливании металлической Медь на воздухе (при избытке кислорода) и солей (азотно-кислой, углекислой и пр.), а также гидрата окиси Медь Указывают, что CuO, полученная из азотно-медной соли, удерживает в значительном количестве азот (на 1 г до 1,5 куб. см), который выделяется в пустоту; это нужно иметь в виду при употреблении CuO для анализа. В порошке CuO очень гигроскопична; при очень сильном накаливании она выделяет кислород и дает низшие окислы Медь В вольтовой дуге (в электрической печи Муассана) она разлагается на Медь и кислород. Водород, уголь, органические вещества при накаливании легко сжигаются за счет кислорода окиси Медь, на этом основывается применение ее для анализа. CuO при сплавлении дает зеленые стекла. Из солей, отвечающих окиси Медь, едкие натр или кали на холоде выделяют гидрат Сu(НО) 2 голубого цвета. Он малопрочен при хранении при обыкновенной температуре и еще легче при нагревании выделяет воду и дает CuO, в крепких щелочах (NaНО и КНО) немного растворяется, легко растворяется в аммиаке и дает известный Швейцеров реактив (см. Волокна растений, Инкрустирующее вещество, Клетчатка). Гидрат окиси Медь служит для приготовления красок. Двуокись Медь CuO 2 получена Тенаром при действии перекиси водорода на гидрат окиси Медь или на азотно-медную соль Cu(NO 3)2 со щелочью, бурое вещество, легко разлагающееся при нагревании; аммиачный раствор медного купороса с перекисью водорода дает CuO2H2 O. При сплавлении Медь с селитрой и КНО или CuО с хлорноватисто-кислыми солями Фреми получил щелочные соли медной кислоты (вероятно CuO 3), растворимые в воде, малопрочные, разлагающиеся с выделением кислорода. Указывают на существование других окислов, напр. Cu 3O, Cu3 О 2, Cu5 О 3 и пр., но они мало изучены. Хлористых соединений известно два, Cu 2Cl2 и CuCl 2. Полухлористая M. Cu2Cl2 получается при действии хлора на накаленную Медь в избытке, при растворении Cu 2 О в соляной кислоте без доступа воздуха и во многих случаях при восстановлении растворов CuCl 2; так действует, напр., металлическая Медь, но в особенности удобен сернистый газ SO 2 или сернисто-кислые соли, например:
2CuCl2 + SO2 + 2H2O = Cu2Cl2 + H2SO4 + 2НCl.
Подобным же образом Cu 2Cl2 получается при восстановлении CuCl 2 хлористым оловом, фосфорноватистой кислотой и пр. или прямо при накаливании СuCl 2. Полухлористая Медь не растворима в воде, растворяется в растворе поваренной соли, в соляной кислоте и аммиаке дает бесцветный раствор. Как сама Cu 2Cl2, так в особенности ее растворы легко окисляются на воздухе и синеют. Растворы в НCl и NH 3 поглощают окись углерода и употребляются в газовом анализе для ее определения. Аммиачный раствор поглощает также ацетилен, а соляно-кислый — фосфористый водород Н 3 Р. Cu 2Cl2 дает двойные соединения с NН 4 Cl, КСl, BaCl 2, CuO и NH 3. Хлористая M., CuCl2, безводная получается при действии хлора в избытке на Медь или Cu 2Cl2 при нагревании; водная — при растворении CuO или CuСО 3 в соляной кислоте. CuCl 2 при кристаллизации из водных растворов дает гидрат CuCl 2 2Н 2 О. При растворении CuCl 2 в воде при обыкновенной температуре цвет получается различный, в зависимости от концентрации (от темно-зеленого до синего); это объясняется образованием разных гидратов (CuCl 2 + 7Н 2 О для зеленого и CuCl 2 + 12H2 O — для синего раствора). То же изменение цвета происходит для некоторых растворов и с изменением температуры. Растворимость CuCl 2 в воде при прибавлении соляной кислоты сначала уменьшается, а потом увеличивается, как бы указывая на переход одних гидратов в другие. CuCl 2 дает двойные соединения с КCl, NH 4ClNH3 и пр., в особенности существует много соединений с CuO — так наз. хлорокиси Медь Известны соединения с 1, 2, 3, 4, 6 CuO; они являются обыкновенно в виде гидратов; некоторые из них встречаются в природе, например CuCl 2.3CuО + 7НО 2 (атакамит). Получаются они при неполном осаждении CuCl 2 щелочью. Бромистых соединений тоже два: Cu 2Br2 и CuBr 2. Полубромистая M. Cu 2Br2, подобно Cu 2Cl2, получается при накаливании CuBr 2 или металлической Медь, взятой в избытке, в парах брома; в воде также не растворима и также растворяется в HBr, HCl, NH 3 и пр. CuBr 2 по способу получения и по свойствам напоминает CuCl 2. Из йодистых соединений Cu 2J2 наиболее постоянно. Оно получается при нагревании Медь в парах йода, при растворении Медь в HJ; при осаждении растворимых солей окиси Медь йодистым калием; при этом выделяется свободный йод, например 2CuSO 4+4KJ=Cu2J2+2K2SO4+J2. Йода выделяется столько, сколько соединилось с Медь Эта реакция настолько характерна, что предложена для определения Медь титрованием. Cu 2J2 не растворима в воде, растворяется в NH 3, KCN, Na2S2O3 и кислотах. CuJ 2 вещество очень непрочное, существует только в слабых растворах и известно в соединении с NH 3. Со фтором Медь дает Cu 2F2 и CuF 2; первое получается растворением Cu 2 O в HF и представляет вещество, не растворимое в воде и слабой HF; второе получается при действии HF на CuO или CuСО 3. В воде CuF 2 плохо растворимо, дает легко двойные соединения с KF, Al 2F6, SiF4, BF3 и пр. При нагревании порошкообразной CuО при 250° в токе NH 3 получается азотистая M. Cu6N2, взрывающаяся при нагревании до 300°. Фосфор и мышьяк во всех пропорциях соединяются с М.; указывают, однако, и на существование определенных соединений, например Cu 2P2, Cu3P2, Cu6As2 и проч. То же можно сказать и относительно кремния, присутствие его увеличивает твердость Медь; при содержании его около 50% получается Медь твердая, как сталь, и очень ломкая. Из соединений с серой известны, главным образом, два: Cu 2 S и CuS, оба встречающиеся в природе. Cu 2 S получается при сплавлении Медь с серой, при сдавливании смеси Cu и S в порошке или растирании с водой, при накаливании CuS или CuSO 4 в струе водорода и пр. Это вещество черного цвета, окисляющееся на воздухе, плохо растворимое в НCl, с HNO 3 переходящее в CuS. При очень сильном накаливании водород восстанавливает его; при сплавлении с CuO получается металлическая Медь или Cu 2 O, смотря по пропорции CuO. Cu 2 S образует двойные соединения с сернистыми металлами, встречающиеся в природе, напр. с железом Cu 2S.Fe2S З (халькопирит) и целый ряд соединений, где процентное содержание S, Fе и Сu очень меняется; с сурьмой известно Cu 2S.Sb2S3 — халкостибит и пр. CuS получается, главным образом, при осаждении медных солей (окиси) сероводородом или сернистыми щелочами. Кипящая соляная и крепкая азотная кислота, цианистый калий растворяют CuS, то же немного и сернистый аммоний; на воздухе она окисляется, переходя в CuSO 4; при сильном накаливании переходит в Cu 2 S. Водород и окись углерода при накаливании восстанавливают ее. Кроме Cu 2 S и CuS указывают на существование многосернистых соединений Медь, которые получаются при осаждении медных солей многосернистыми щелочами, но они мало изучены.
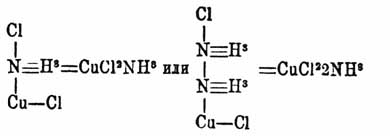
Кислородные соли. Известны гл. обр. соли, отвечающие окиси Медь; соли закиси малопрочны и плохо исследованы. Окись Медь, хотя принадлежит к слабым основаниям, однако, легко соединяется даже с самыми слабыми кислотами; в то же время она образует легко основные и двойные соли. Соли окиси Медь бывают обыкновенно окрашены (синего, голубого, зеленого цвета). Азотно-медная соль C u(NО 3)2 получается при растворении M. CuO или углемедной соли в азотной кислоте, при испарении раствора около 20—25° выделяются кристаллы с 3 частицами воды Cu(NО 3)2 + 3H2 O, а ниже 20°, Cu(NО 3)2+6H2 O; последняя при высушивании в разреженном пространстве легко выделяет 3 частицы воды. Cu(NО 3)2 +3Н 2 О легко растворима в воде и спирте. Она малопрочна, и из нее нельзя нагреванием выделить воду без разложения: при 114° она плавится, при 170° уже выделяет элементы азотной кислоты, образуя основные соли; при прокаливании переходит в CuО. Было указано (Ричард и Роджерс), что полученная таким образом окись Медь удерживает значительное количество газов, так что, когда идет вопрос о получении совершенно чистой CuO (как, напр., для определения атомных весов), этот путь совершенно непригоден. Cu(NО 3)2 + 3Н 2 О взрывает при нагревании с углем, а смешанная с фосфором — при ударе; при выпаривании раствора Cu(NО 3)2 + 3Н 2 О и NH 4NO3 тоже происходит взрыв. Основные азотно-медные соли образуются как при действии высокой темп. на Cu(NО 3)2 + 3Н 2 О, так и при растворении в ее растворах Cu(НО) 2, CuСО 3 и даже металлической Медь Из них можно назвать Cu(NО 3)2 + 3(CuН 2 О 2), соединение мало растворимое в воде, но вообще, подобно другим основным солям Медь, они мало изучены. Азотисто-медная соль Cu(NO2)2 получается двойным разложением медного купороса CuSO 4 и азотисто-кислого бария или свинца. Она малопрочна, на воздухе окисляется, и растворы ее постепенно разлагаются, выделяя окись азота. С углекисл. Медь дает исключительно основные углемедные соли. Они не растворимы в воде и служат для приготовления красок. Осаждая раствор медного купороса содой на холоде, получают рыхлый осадок голубого цвета CuCOЗ CuO + 2H2 O. При легком нагревании он зеленеет, теряет частицу воды и переходит в малахит CuСО 3 + Cu(НО) 2; при дальнейшем нагревании он теряет элементы угольной кисл. и воду и дает соединения, еще более основные. В природе встречается соединение состава 2CuCO 3 + CuOH2 O, азурит, медная лазурь, в виде призм одноклиномерной системы. Дебрэ получил ее при действии раствора азотно-медной соли на мел в запаянных трубках на холоде при давлении 3 — 4 атмосфер. Из медных солей, вообще говоря, наибольший интерес представляют соли, отвечающие серной кислоте. Безводная серно-медная соль CuSO4 получается при нагревании медного купороса CuSO 4 + 5H2 O выше 200° в токе сухого воздуха. По некоторым указаниям, при выделении последних следов воды уже происходит, отчасти благодаря высокой темп., разложение CuSO 4. При сильном накаливании CuSO 4 выделяет SO 3 и О и переходит в СuО, хотя удалить последние следы серной кисл. невозможно. Уголь и водород при нагревании восстанавливают ее до металла. CuSO 4 жадно поглощает влагу и служит в лабораторной практике для высушивания. Она поглощает также HCl и NH 3 (см. ниже). Медный купорос CuSO4 + 5H2O получается при растворении Медь, окиси Медь, углемедной соли и пр. в серной кисл. и последующей кристаллизацией полученных растворов. CuSO 4 + 5H2 O выделяется в виде синих кристаллов триклиномерной системы и хорошо растворимых в воде. 100 частей воды растворяют CuSO 4 + 5H2 O при 0° — 31,61 частей, при 10° — 36,95, при 20° — 42,31, при 30° — 48,81, при 40° — 56,90, при 50° — 65,93, при 60° — 77,39, при 70° — 94, при 80° — 118,03, при 90° — 156,44, при 100° — 203,32 (Poggiale). Абсолютный спирт не растворяет медного купороса, но водный его немного растворяет. Глицерин растворяет при 15° около 30 частей на 100. CuSO 4 + 5H2 O выветривается в сухом воздухе, выделяя 2H 2 O при обыкновенной темп.; при 100° он теряет еще 2H 2 O. Для CuSO 4 известны гидраты с 1, 2, 3, 5, наконец, с 6 и 7 частицами воды. Гидрат CuSO 4 + 7H2 O получается, когда пересыщенный раствор медного купороса кристаллизуется в присутствии кристаллика железного купороса, a CuSO 4 + 6H2 O — в присутствии кристаллика серно-кислого никеля. Медный купорос (см.) находит многообразное применение в практике. Для CuSO 4 известен ряд основных солей. Они образуются при действии высокой температуры на CuSO 4 или при действии щелочи. Некоторые из них встречаются в природе. Для CuSO 4 известно множество двойных солей: (NH 4)2Cu(SO4)2 + 6H2O, K2Cu(SO4)2 + 6H2 O и пр. Медные соли, подобно солям многих других металлов, напр. Hg, Рt, Ag, Zn, Со и пр., дают многочисленные соединения с аммиаком. Общий вид их CuX 2nNH3 или Cu 2X2nNH3, соответственно двум типам медных соединений. В состав их может входить также некоторое число частиц воды, и они могут соединяться с кислотами. Соединения эти не отличаются большой прочностью; они сравнительно легко выделяют аммиак при нагревании и при растворении в большом избытке воды, и чем больше в них находится аммиака, тем прочность их меньше. Одни рассматривают эти соединения как отвечающие соединениям аммония (NH 4), в котором часть водорода заменена Медь; напр., замещая два атома водорода в двух частицах аммония Медь, получим Сu(NH 3)2 [или Сu 2(NH3)2 ], двухатомную группу, замещающую в кислотах 2 атома водорода, так что, напр., хлористо-водородная соль будет Сu(NH 3)2Cl2 = CuCl22NH3 и пр. В группе Cu(NH 3)2, со своей стороны, атомы водорода могут, по этой теории, замещаться аммонием, так что является возможным образование двухатомного радикала вида Cu(NH 3)n [или Cu 2(NH3)n], где n совершенно неопределен. Другие видят в них соединения пятиатомного азота, например
и пр. В других случаях вместо Сu фигурирует двухатомная группа Сu—Сu, одним своим сродством связанная с азотом. Наиболее естественным представляется третий взгляд на аммиачные соединения Медь, поддерживаемый проф. Менделеевым. Он видит в них соединения, подобные соединениям с кристаллизационной водой; они определяются теми же, еще малоисследованными силами. Это сходство нагляднейшим образом проявляется в том, что часто аммиак в таких соединениях замещается водой и обратно. Напр., пропуская через безводную CuSO 4 аммиак, получают CuSO 45NH3, аналогично CuSO 4 5Н 2 О; во влажном воздухе оно дает CuSO 4NH3H2O и CuSO 42NH33H2 O; известно также CuSO 4NH3H2 O и пр. Раcсмотрим некоторые из аммиачных соединений Медь Для растворения безводной СuО в водном аммиаке требуется, по-видимому, присутствие аммиачных солей; гидрат же растворяется очень легко; полученному соединению приписывается состав CuO4NH 3 + вода. Подобное же соединение происходит при действии водного аммиака на Медь в присутствии воздуха. Кислород воздуха частью окисляет Медь, частью окисляет NH 3 в азотистую кислоту, которая дает с избытком NH 3 азотисто-аммиачную соль. Реакция сопровождается значительным разогреванием. Аммиачный раствор окиси Медь синего цвета. При действии на него Медь без доступа воздуха он постепенно обесцвечивается; в растворе тогда предполагается существование соединения Cu 2O(NH3)4. Оно очень жадно поглощает кислород, окись углерода, ацетилен и во многих случаях действует как энергичный восстановитель. При действии аммиака на Cu 2 Сl 2, смотря по температуре, получаются соединения с 4, 2, 1 частицами аммиака. Эти вещества легко окисляются и присоединяют НСl соответственно в количестве 4, 2, 1 частицы. Для CuC 2 известны соединения с 6, 4, 2 частицами аммиака; для CuBr 2 c 5, 3 частицами; Сu 2J2 дает Сu 2J2 4NН 3; при действии аммиачного раствора окиси Медь на спиртовой раствор йода в йодистом калии получаются соединения СuJ 2 4NН 3, СuJ 2 NН 3J2, СuJ 2 4NН 3J4 и пр. Для CuSO 4, кроме указанных, известны соединения с 2 частицами NH 3 и пр .
Анализ медных соединений. Для качественного определения Медь в ее соединениях могут служить следующие реакции (имея в виду лишь соединения окиси Медь, так как закисные встречаются только в специальных условиях). Прежде всего, выделение Медь в металлическом виде. В слабый, слегка подкисленный раствор медной соли опускают кусочек железа или цинка, обернутый платиновой проволокой; на ней выделяется Медь Соединения Медь, внесенные на платиновой проволочке в пламя бунзеновской горелки, окрашивают его в зеленый цвет. Лучше всего это удается с хлорной M. CuCl 2; поэтому пробу смачивают соляной кислотой. При сплавлении с бурой на платиновой проволоке в окислительном пламени Медь дает зеленое стекло, которое при охлаждении становится синеватым; в восстановительном пламени (лучше с прибавкой станиоля) стекло получается красным (при охлаждении). Одна из характернейших реакций на Медь состоит в образовании с желтой солью красно-бурого осадка железисто-синеродистой M. Cu 2Fe(CN)6. Слабые кисл. не разлагают его; щелочи разлагают. Для характеристики может служить образование гидрата окиси Медь или углекислой соли голубого цвета при действии NaНO или Na 2 СO 3, образование CuS, образование белых осадков синеродистой и роданистой Медь CuCN и CuCNS, отвечающих закиси и получающихся при действии KCN или KCNS на соли окиси Медь в присутствии сернистого газа SO 2. В слабых кислотах они не растворимы. CuCN растворяется в KCN. Можно указать, наконец, на образование синих растворов с аммиаком, как на одну из наиболее характерных и чувствительных реакций на Медь См. также ст. Микрохимия. Для количественного определения Медь существует несколько способов. 1) Определение в виде металлич. Медь Для этого Медь берется в виде CuSO 4 или CuCl 2 (с некоторым количеством свободной кислоты) и помещается во взвешенную платиновую чашку; сюда же кладется кусочек чистого цинка, и чашка накрывается стеклом. Водород не должен выделяться бурно. Медь получается в виде бурого осадка. Убедившись в полноте осаждения и дав цинку раствориться, Медь промывают декантацией горячей водой и затем спиртом, сушат при 100° и взвешивают. То же самое получают, подвергая раствор медной соли электролизу слабым током (см. Электрохимический анализ). 2) Определениe в виде СuО. Раствор нагревают до кипения в платиновой чашке и осаждают едким натром. Осадок нагревают до кипения, пока он не сделается черным; его промывают сначала декантацией и затем на фильтре. Осадок высушивают и прокаливают в платиновом тигле; фильтр сжигается отдельно. При этом способе необходимо, чтобы растворы были слабы, иначе осадок будет заключать неразложившуюся медную соль и, кроме того, его будет трудно промыть. 3) Наибольшей точностью обладает определение Медь в виде Cu 2 S. Осадив Медь сероводородом в виде CuS, осадок быстро промывают сероводородной водой, чтобы он не окислился на воздухе, высушивают его и помещают в тигель Розе из неглазурованного фарфора; фильтр сжигается отдельно и тоже кладется в тигель. Тигель слегка прокаливается в струе водорода, который с помощью фарфоровой трубочки вводится внутрь его через отверстие, имеющееся в крышке. Когда имеется Медь в виде окиси, серно-кислой, углекислой Медь, Cu(SCN) (как бывает при анализе), вообще в соединении с летучими кислотами, можно прямо смешать вещество с серой и прокаливать вышеуказанным образом. Существует множество способов и для объемного определения Медь, напр. осаждают Медь йодистым калием в виде Сu 2J2 и титруют выделившийся йод, например
2CuSO4 + 4KJ = Cu2J2 + 2K2SO4 + J2;
в других случаях титруют хлористым оловом SnCl 2 , например
2CuCl2 + SnCl2 = Cu2Cl2 + SuCl4;
конец указывается обесцвечиванием раствора; титруют также желтой солью и проч. Отделение Медь от металлов щелочных, щелочно-земельных, алюминия, железа, марганца, цинка, кадмия, хрома, кобальта и никеля производится на основании нерастворимости CuS в слабых кислотах; от олова, мышьяка, сурьмы, золота и платины — на основании нерастворимости CuS в сернистом аммонии. От серебра Медь отделяется на основании нерастворимости в воде AgCl, от свинца — на основании нерастворимости в воде PbSO 4. От Ag, Hg и Cd Медь отделяется на основании растворимости CuS в KCN; для этого вещество растворяется в KCN и осаждается сероводородом. Медь остается в растворе.
С. Вуколов. Δ.
Медные руды. Месторождения медных руд встречаются в породах почти всех формаций; но более обильны в пермских и лиасских формациях. Самородная Медь встречается в отдельных массах иногда значительных размеров или в виде тонких пластинок и волокнистых отложений; также в виде песка или мелких зерен, смешанных с кварцем. Самородная Медь тягуча, ковка и чрезвычайно вязка; в большинстве случаев она очень чиста, но иногда содержит незначительное количество серебра; чилийская Медь содержит 7 — 8% серебра. Самородная Медь встречается в Соед. Шт. Сев. Америки (на берегах Верхнего озера), в Бразилии, Чили, Перу, Сибири, на Урале, Фарерских о-вах и в Англии. Красная медная руда (Сu 2 O). В чистом виде содержит 88 — 73% M. Она встречается в крупных массах или зернах. Местонахождения ее: Корнваллис, Нью-Джерси, Урал, Алтай, берега Верхнего озера, Южная Америка и Австралия. Черная медная руда (СuO). Содержит 79,8% Медь, но редко бывает чистой. Руда эта встречается на берегах Верхнего озера, в Саксонии, Чили и в знаменитых рудниках "Бура-Бурра" в Австралии. Медный колчедан (CuFeS2). Это самая распространенная медная руда. В чистом виде она содержит 34,81% Медь, но среднее содержание руды не превышает 7 — 8%. Руда эта имеет желтый металлический оттенок и отличается от железного колчедана меньшей твердостью. Месторождения его находятся в Испании, Англии, Швеции, Саксонии, Австралии, Сев. и Южн. Америке, на Кавказе и Урале. Малахит (СuСO 3 + CuOH2 O) содержит 57% Медь Он встречается в виде массивных слоистых желваков и намывов на Урале, в Сибири, Южн. Америке, Австралии и Соед. Штатах. Медная лазурь (2CuCO З + CuOH2 О) содержит 55,16% M. и встречается вместе с малахитом в Австралии, Корнваллисе, Франции и в Соед. Штат. Медный блеск, пестрая медная руда и серая медная руда — встречаются вместе с другими сернистыми рудами в Саксонии, Англии, на Урале и пр. Медный фальэрц представляет темно-серую, хрупкую руду, находящуюся как в виде сплошных масс, так и в виде кристаллов. Представляет сернистую медь, в которой Медь более или менее замещена железом, цинком, серебром, ртутью и неопределенными количествами сернистых соединений мышьяка и сурьмы. Серебристый фальэрц иногда содержит до 30% серебра и не более 15% Медь, а в других случаях — лишь следы серебра и до 43% M. Фальэрц встречается в Корнваллисе, Саксонии, Венгрии, Мексике и проч. Горная зелень (водный силикат Медь) и атакамит (хлорокись Медь) иногда выплавляются для получения Медь Первый встречается вместе с другими медными рудами в Корнваллисе, Саксонии, Новой Шотландии, Чили, Австралии, Сибири и на берегах Верхнего озера; второй тоже находится в Чили, Австралии, Саксонии и проч .
Металлургия Медь Механическое обогащение руды. Предварительно, до чисто металлургической обработки, медные руды подвергаются механическому обогащению. Часто руду грубо сортируют в самом забое, но в большинстве случаев вся добытая руда доставляется на поверхность, где сначала отделяют крупную руду от рудной мелочи. Крупные куски затем раздробляются на куски весом от 2 до 3 фн. Полученная таким образом руда разделяется на 3 сорта, а именно на "богатую руду", "бедную руду" и "пустую породу". Богатая руда подвергается вторичному измельчению и разделению на 3 сорта. Эта работа обыкновенно производится женщинамию, и полученная богатая руда идет прямо к толчеям. Бедная руда первой сортировки тоже подвергается вторичному обогащению и в некоторых случаях вновь подразделяется на 3 сорта. Таким образом вся руда, кроме мелочи, приводится в 2 сорта, и выбрасывается значительная часть пустой породы. Богатую руду пропускают через дробильные валки, или толчеи, для окончательного дробления и затем пускают в серию грохотов с отверстиями от 4 до 64 шт. на кв. дюйм. Бедная руда дробится гораздо мельче богатой и впоследствии подвергается дальнейшему обогащению при промывке с помощью различных приспособлений , как то: промывальных чанов, неподвижных штосгердов, отсадочных решеток и проч.
Извлечение Медь из руд производится двумя способами; огненным и мокрым путем. Огненные способы подразделяются на два главных рода: способ английский и германский. В общем, оба способа состоят из ряда последовательных операций обжигания и сплавления, посредством которых сера и другие посторонние вещества постепенно выделяются. Но способы эти явно различаются. По английскому способу операция производится в отражательных печах, совершается сравнительно быстро, но требует сложных манипуляций и опытных рабочих. Она кончается восстановлением Медь вследствие взаимодействия окиси Медь и сернистой Медь, например CuS+2СuО=3Сu+SО 2. По германскому способу операция, наоборот, идет медленно. Обжигания производятся в открытых кучах, в стойлах, в шахтенных печах или в особенных обжигательных печах, как то: печах Герстенгофера, Спенса, Брюкнера и пр. Сплавления же производятся в невысоких шахтенных печах. Этот способ выгоднее для бедных и нечистых руд и оказывается более экономичным, где топливо дорого. В главных чертах, германский способ, как практикующийся в Саксонии, Соед. Штатах и на Кавказе для обработки сернистых руд, состоит из следующих операций. 1) Обжигание руды в кучах от 50 до 100 тонн. 2) Плавка на купферштейн. Обожженная руда смешивается со шлаком, полученным в следующей плавке и кремнистыми флюсами, в отношении 10 частей руды, 5 частей шлака и 1 части флюса, и плавится в шахтенной печи. При этом окись железа переходит в шлак, благодаря его сродству к подмешанному кремнезему, и Медь в виде сернистой Медь, или "купферштейна", плавится, собираясь под шлаком. 3) Обжигание купферштейна. Полученный в предыдущей операции купферштейн измельчается и обжигается для дальнейшего окисления железа и проч. 4) Плавка на более богатый купферштейн. Обожженный купферштейн подвергается вторичному сплавлению в шахтенных печах, с кремнеземистыми шлаками и флюсами. При этом содержание Медь возвышается до 45 — 50%. 5) Обжигание концентрированного купферштейна. Здесь окисление производится более совершенно, чем в предыдущем обжигании. 6) Плавка на черную Медь При этой плавке часть Медь уходит в так наз. дюннштейн, в котором содержится почти вся сера, заключавшаяся в купферштейне. Дюннштейн содержит около 65% Медь 7) Обжигание дюннштейна. 8) Вторая плавка на черную Медь и дюннштейн. 9 — 10) Обжигание дюннштейна и новая плавка на черную M. 11 — 12) Рафинирование черной Медь Оно производится или в открытых горнах с дутьем, или в шплейзофенах. При этом все примеси, как то: железо, свинец, никель, кобальт, сурьма и сера, окончательно окисляются и удаляются в шлак. Понятно, что приемы германского способа и ход операции много изменяются, смотря по местностям. Напр. в Соед. Штатах плавка производится в шахтенных печах с железным кожухом, обложенным кирпичами и снабженным так наз. водяной рубашкой. Последняя лежит около фурм и состоит из ряда пустых чугунных или железных ящиков, через которые свободно течет вода, благодаря этому температура стен этой части печи никогда не превышает 70°С, хотя внутри поддерживается самый сильный жар. Последнее видоизменение представляет печь Гересгофа. Она имеет вид усеченной пирамиды почти квадратного сечения, которая широким основанием лежит кверху; выс. 10 фт., шир. на дне 3 фт. 7 дюймов и 7 фт. 4 дюйма в верхней части. Число фурм 13. Водяная рубашка из котельного железа и представляет кольцеобразное пространство — 2 дюйма толщ. Дно печей тоже железное с подкладкой из песка. Печь стоит на чугунных колоннах и снабжена устройством для автоматического выпускания шлака и купферштейна. На Урале, Кавказе и в Швеции употребляют прямоугольные кирпичные печи высотой ок. 20 фт.
Английский или валлийский способ. В этом способе смешивают сравнительно бедные сернистые руды, содержащие значительное количество железа и от 5 до 15% Медь, с богатыми рудами того же состава, но содержащими от 15 до 25% Медь и с медными колчеданами и кислородными рудами, в таких пропорциях, чтобы получить состав, содержащий от 9 до 15% Медь Ход обработки изменяется смотря по составу руд, но обыкновенно заключается в следующих шести процессах. 1) Обжигание руд; здесь мышьяк, сурьма и другие летучие вещества удаляются вместе с частью серы, которая, как и железо, окисляется. Обжигания никогда не бывает полного; часть серы всегда оставляют для дальнейших операций. 2) Плавка на роштейн (Rohstein). Обожженную руду плавят вместе с богатым Медь шлаком из 4-й операции, плавиковым шпатом и кислородными рудами. При этом получаются два продукта — роштейн, в котором сконцентрирована вся Медь, и шлак, содержащий не более 0,5% Медь, который выбрасывается. Роштейн содержит 30 — 35% Медь, 23% серы и довольно значительные количества мышьяка, сурьмы и олова. 3) Обжигание роштейна; обжигание производится неполное, но степень его зависит от количества имеющихся кислородных руд для следующей операции. 4) Плавка обожженного роштейна. В этой операции употребляются обожженный роштейн и сернистые руды, содержащие мало железа. Сюда добавляются также кислородные руды, свободные от мышьяка, сурьмы и олова. Получается два продукта — роштейн, содержащий 65 — 80% Медь и 18 — 22% серы, и железистый шлак, содержащий немного окиси Медь и крупинки металлической Медь Этот шлак идет на первую плавку. 5) Обработка роштейна. Этот процесс очень сложен и заключается в ряде сплавлений и обжиганий, в окисляющей атмосфере. Цель его — очищение роштейна от железа и восстановление возможно большего количества Медь до металла. Получаются два продукта — черная Медь, содержащая около 98% Медь, и шлак, который всегда заключает крупинки металлической Медь и который добавляется к плавке № 4. Здесь главными реакциями являются следующие:
Cu2S + 2Cu2O = 6Cu + SO2, Cu2S + 2Cu2O = 4Cu + SO2.
6) Рафинирование черной Медь Здесь Медь окончательно очищается от посторонних веществ, посредством их окисления. Полученный шлак содержит до 55% Медь и идет на плавку № 4. Рафинирование производится следующим образом. Берут около 10 тонн черной Медь, которая кладется в печи в виде слитков. Сначала температура печи медленно повышается до точки плавления Медь, а потом сдерживается, чтобы продлить сплавление и дать ход окислению примесей. Затем температуру снова повышают, при чем образуется жидкий шлак, богатый Медь Шлак снимают и покрывают поверхность расплавленной Медь слоем угля. Происходящее сильное выделение газов энергично перемешивает Медь с углем, и растворенные в металле окислы Медь восстанавливаются. При валлийском способе употребляются исключительно отражательные печи, в которых площадь горна обыкновенно составляет одну пятую часть площади рабочего пространства. Обжигательные печи имеют очень глубокий горн, чтобы получить восстановляющие газы. Воздух же имеет свободный доступ через отверстие в пороге горна. Руда нагружается плоским насыпом, устроенном на печи и в котором руда предварительно сушится. Внутренние размеры печи обыкновенно от 21 до 30 фт. длиной и 12 фт. шириной. Печи, в которых производится плавка роштейна, устраиваются как для высоких температур, притом горн их бывает больше, сравнительно с рабочим пространством. Для набойки пода служат песок и шлак из 4-й плавки. Набивка идет слоями и имеет толщину 15—20 дюймов. В глубине печи устроена дверца, через которую рабочий снимает образовавшийся шлак. Под печи длиной около 14 фт.
В последнее время для рафинирования роштейна прямо в чистую Медь применяется бессемерование. Это применение в усовершенствованном виде составляет изобретение франц. инженера Mauh é s; в Соед. Штатах производится оно следующим порядком: употребляемый роштейн содержит 50% Медь, 22% железа и 26% серы. Если присутствуют цинк, свинец, сурьма или мышьяк, то они частью улетучиваются в конверторе и частью шлакуются. Роштейн предварительно плавится в шахтенной печи и прямо вливается в конвертор в расплавленном виде. Употребляемые конверторы мало отличаются от тех, которые обыкновенно служат для бессемерования стали и вмещают около 2 тонн роштейна. Воздух входит в конвертор под давлением от 8 до 12 фн. на квадратный дюйм; первое его действие состоит в окислении сернистого железа по уравнению: 2FeS+7О=Fe 2O3+2SO2. Образующаяся окись железа, приходя в соприкосновение с раскаленной кремнеземистой подкладкой конвертора, соединяется с ней и шлакуется. Эта часть процесса характеризуется выделением густых белых паров с розовым и зеленым оттенками. Сначала розовый оттенок исчезает, потом белые пары постепенно превращаются в зеленые. Когда все железо соединилось с кремнеземом, то пары становятся синими; дутье прекращают, конвертор опрокидывают и шлак сливают тонкой струей; потом конвертор вращают обратно и снова пускают дутье. Теперь в конверторе находится исключительно купферштейн, так как все железо ушло уже со шлаком, а свинец, цинк, мышьяк и сурьма улетучились. В начале второй части процесса является небольшое синее пламя, иногда смешанное с белым; оно постепенно изменяется; синий оттенок исчезает и превращается в розовый, потом в красный и, наконец, в красно-бурый. Пламя постепенно сокращается, и в конце операции видно лишь тонкое языкообразное пламя; тогда конвертор опрокидывают, и очищенная Медь отливается в изложницы .
Мокрые способы применяются исключительно для таких бедных руд, в которых пустая порода не подвергается действию кислот. Растворение Медь производится различными путями. Для сернистых руд сначала превращают сернистую Медь в серно-кислую Медь посредством обжигания и выветривания, и потом выщелачивают образовавшуюся соль водой; или же, при обработке кислородных соединений, руда прямо подвергается действию кислот. Растворенная Медь осаждается железным или чугунным ломом. На Кавказе в Кедабекском заводе мокрым путем обрабатывают бедные сернистые руды, содержащие менее 5% Медь Чтобы перевести Медь, заключающуюся в этих рудах в раствор, их предварительно обжигают, после чего до 30% содержащейся в руде Медь становится способной растворяться в воде. Подвергая затем эти руды действию атмосферы воздуха в течение 2 — 3 лет, можно почти всю Медь перевести в растворимое состояние. Когда в рудах остается лишь 0,5% Медь, то становится невыгодным извлекать ее мокрым путем. С целью выветривания руды, а также и выщелачивания ее, имеется около рудничной станции Кедабекской жел. дор. большая наклонная площадь, которая, с целью сделать ее водонепроницаемой, покрыта полудюймовым слоем асфальта. Выше обозначенной площади, по склону той же горы, производится обжигание бедных руд либо в печах Герстенгефера, либо просто в кучах. Обожженная руда располагается на упомянутой асфальтированной площади ровным слоем до 3 фт. толщиной, после чего ее постоянно орошают. Как только обнаруживается присутствие медного купороса в выщелачивающей воде, то всю ее направляют по деревянным желобам в ряд нижерасположенных деревянных ящиков, в которых Медь осаждается посредством железа. Полученная таким образом, Медь содержит около 50% чистой Медь; она собирается, сушится и затем плавится на чистую Медь Извлечение чистой Медь из черной Медь путем электролиза производится в громадных размерах в Германии, Англии, Франции и в последнее время в России. На Калакентском заводе на Кавказе ванны для осаждения Медь представляют собой деревянные ящики длиной в 2 м, при ширине в 1 м и высоте в 0,85 м; внутренние стенки их асфальтированы. В каждом ящике подвешены попеременно 16 анодов и 17 катодов. Аноды отлиты из черной Медь и имеют в длину 90 см и в ширину 60 см. У каждого анода имеется по два ушка из загнутых толстых медных полос, которыми анод с каждой стороны подвешивается на проводы. Катоды, тех же размеров, как и аноды, отливаются из чистой Медь; они подвешиваются в ваннах посредством узких медных пластинок на деревянных брусочках; с проводниками они соединяются также медными полосками. Расстояние между анодами и катодами 9 — 10 см. Ванны наполняются раствором медного купороса. Раствор постоянно циркулирует в ваннах; каждая ванна соединяется с динамоэлектрической машиной. Провода, служащие анодами и катодами, расположены по длинным сторонам ванн и сделаны из Медь Под влиянием тока анод постепенно растворяется, и чистая Медь осаждается на катоде. Черная Медь обыкновенно содержит около 92% Медь, затем — железо, свинец, цинк, серебро (от 0,05 до 0,1%), также сурьму и мышьяк. При электролизе эти примеси садятся на дно ящиков.
Статистика меди. Mиpовoe производство Медь выражалось в 1891 г. следующими цифрами:
| Получено меди (пудов). | |
| Соединенные Штаты Сев. Америки | 8185319 |
| Великобритания и Ирландия | 4552796 |
| Испания | 2725053 |
| Германия | 1506053 |
| Чили | 1232250 |
| Япония | 1096292 |
| Австралия | 492758 |
| Венесуэла | 387716 |
| Боливия | 366000 |
| Италия | 364597 |
| Россия | 333069 |
| Мексика | 317750 |
| Канада | 259494 |
| Франция | 128100 |
| Австро-Венгрия | 79910 |
| Швеция | 40260 |
| Ньюфаундленд | 29280 |
| Норвегия | 18300 |
| Перу | 9272 |
| Аргентина | 6324 |
| Всего | 22130640 |
Отсюда видно, что главными производителями Медь являются Соед. Штаты Сев. Америки, Великобритания и Испания, которые вместе дали в 1891 г. до 70% общего количества выплавляемой Медь Что же касается России, то она занимала в этом отношении лишь 11-е место и участие ее в мировом производстве Медь не превосходило 1,5%. В России Медь выплавлялась в 1891 г. на 25 заводах; из них 9 действовали на Урале, 12 на Кавказе, 2 на Алтае и по 1 в Финляндии и Киргизской степи. На этих заводах было приготовлено 8101201 пд. медных руд, причем выплавлено штыковой Медь — 333069 пд., приблизительно на сумму 3854963 руб. Из всего количества выплавленной Медь приходилось на заводы:
| Уральские | 174403 пудов |
| Кавказские | 119552 пудов |
| Алтайские | 13193 пудов |
| Киргизской степи | 1213 пудов |
| Финляндские | 17544 пудов |
Наибольшей производительностью отличался Богословский завод (на Урале), доставивший 81573 пд. Медь; затем следовали заводы Выйский (в Нижн. Тагиле), Калакентский и Кедабекский (на Кавказе) — первый с производительностью 53118 пд., второй 46904 пд. и последний 43514 пд.
Ю. Г. Каменский. Δ.
|
Смотрии так же... |
|