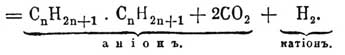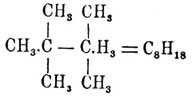Парафины
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| П | ПЕ | ПА | ПЕ | ПЁ | ПЖ | ПИ | ПЛ | ПН | ПО | ПП | ПР | ПС | ПТ | ПУ | ПФ | ПХ | ПЧ | ПШ | ПЫ | ПЬ | ПЭ | ПЮ | ПЯ |
| ПАА |
| ПАБ |
| ПАВ |
| ПАГ |
| ПАД |
| ПАЕ |
| ПАЖ |
| ПАЗ |
| ПАИ |
| ПАЙ |
| ПАК |
| ПАЛ |
| ПАМ |
| ПАН |
| ПАО |
| ПАП |
| ПАР |
| ПАС |
| ПАТ |
| ПАУ |
| ПАФ |
| ПАХ |
| ПАЦ |
| ПАЧ |
| ПАШ |
| ПАЭ |
| ПАЮ |
| ПАЯ |
Парафины (хим.) — предельные (см. Замещение, Предельные соединения) углеводороды ряда C nH2n+2. Парафины встречаются в значительном количестве в природе; низшие члены ряда выделяются во многих местностях из почвы (напр. в Америке — в Пенсильвании, у нас на Кавказе, близ Баку, в Крыму близ Бунганака и т. д.); следующие члены составляют главную массу амер. нефти (см. соотв. ст.) и встречаются в значительном количестве в нефти челекенской и закаспийской (Уоррен, Пелуз, Кагур, Шорлеммер, Харичков) и, наконец, высшие входят в состав канадской нефти (Болей) и различных минералов каменноугольной системы, залежей бурых углей и битуминозных сланцев и известны под названием озокерита (см.), горного воска и т. д. (см. о лекене); особняком стоит нахождение одного из Парафины(нормального гептана) в калифорнийской сосне — Pinus sabiniana (Торпе, Шорлеммер [Существуют указания на присутствие Парафины в розовом масле (?) и в цветах Crysantbemum cinerar i nefolium (? Цукко).]). Образуются Парафины при сухой перегонке дерева, торфа, бурых и каменных углей, битуминозных сланцев (Гревиль Вильямс, Шорлеммер), смол (Ренар), животных остатков, жирных масел, кальциевого мыла из жира рыбы Alosa Menhaden, Парафины собственно (Торпе и Юнг), многих других органических веществ (см. ниже) и при растворении в кислотах чугуна (Клоэз, наряду с нафтенами?). Реакциями получения П являются: 1) замещение в предельных галоидангидридах спиртов С nH2n+1 X (Х = Сl, Вr, J) галоида водородом и восстановление жирных предельных кислот С nH2n О 2 и кетонов С n-1 Н 2n СО; 2) действие воды (кислот) на предельные металлоорганические соединения; 3) присоединение водорода к олефинам (см.): C nH2n + H2 = CnH2n+2; 4) отнятие элементов углекислоты от предельных жирных кислот: (С nH2n+1)СО 2H — CO2 и C nH2n (СО 2H)2 — 2CO2 = CnH2n+2; 5) действие натрия (или цинка) на предельные галоидангидриды спиртов (преимущественно йодюры): С nH2n+1 J + С mH2m+1 J + 2Na = (С nH2n+1)С mH2m+1 + 2NaJ и 6) электролиз жирных кислот (их солей):
При первой реакции действуют на С n Н 2n+1 X водородом в момент выделения, для чего употребляют или амальгаму натрия (также цинк с соляной кисл., цинк с водой при 150° — 160°; Франкланд), напр.: С 2H5J + H2 = C2H6 + HJ, или цинкмедную пару (в присутствии спирта или воды — Гладстон и Трайб), или же нагревают йодангидрид [В этом случае С nH2n+1 J можно заменить спиртом СH 2n+1 (OH).] с йодистым водородом (Бертело): C 2H5J + HJ = C2H6 + J2 [Реакция, по-видимому, ведет иногда к продуктам, изомерным с теми, которые должны бы были образоваться (ср. Полиметиленовые углеводороды); так из маннита (см.) при восстановлении его йодистым водородом получается симметричный диметилбутан — 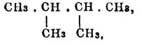 , который образуется и из диаллила(см., Бертело).] или с хлористым алюминием (Кёнлейн). Последний способ ведет к различным продуктам, смотря по темп., при которой происходит взаимодействие С nH2n+1 J с AlCl 3 [Нагревание производят в запаянных трубках, как при восстановлении С nH2n+1 J йодистым водородом . ]; всегда образуются при этом Парафины, и первоначально Парафины, отвечающий взятому йодангидриду, т. е. из йодистого бутила — бутан, из йодистого гексила — гексан и т. д., но высшие члены ряда (до пентана) под влиянием АlСl 3 и образующегося HJ претерпевают, около 125° — 140°, распадение, ведущее к образованию бутана, а этот последний в свою очередь, при температурах 160° — 225°, распадается, превращаясь в пропан; С 3 Н 8 в указанных условиях не изменяется (Лотар, Мейер и Клуге). Что касается восстановления йодистым водородом предельных кислот, то эта реакция применима только к получению высших Парафины, начиная с нормального нонана С 9 Н 20, т. е. с пеларгоновой кисл. (см.; Крафт): C nH2nO2 + 6HJ = CnH2n+2 + 2H2O = 3J2. Нагревают для этого в запаянных трубках 2—4 гр. кислоты с 3—4 ч. йодистоводородной кислоты (уд. в. 1,7) и 1/3 ч. фосфора [Прибавление фосфора облегчает ход реакции, так как в присутствии воды он превращает выделяющийся йод в йодистый водород 2P + 3J 2 + 6H2O = 2P(OH)3 + 6HJ. Фосфористая кислота претерпевает при этом отчасти дальнейшее изменение.] 3—5 часов при 210° — 249°; затем трубки вскрывают, прибавляют в них немного фосфора и снова греют при той же температуре; операцию повторяют раза 2—3; образованный Парафины перегоняют с водяными парами и нагревают с концентрированным едким кали (Крафт). Выход не особенно хороший и в этом отношении гораздо выгоднее восстановление йодистым водородом в тех же условиях кетонов, которые должны быть, однако, предварительно превращены — действием пятихлористого фосфора — в тела общей формулы С n Н 2nCl2 (см. Кетоны). К реакции образования Парафины из йодюров, при нагревании с водой и цинком (см. выше): 2С n Н 2n+1J + 2Zn + 2H2O = 2CnH2n+2 + ZnJ + Zn(OH)2, тесно примыкает реакция разложения цинкоорганических соединений водой; идет она очень энергично и дает чистые продукты: Zn(C 2H5)2 + 2H2O = 2C2H6 + Zn(OH)2 (Франкланд); меркурорганические соединения дают Парафины только при действии кислот: Hg(C 2H5) + HCl = C2H6 + Hg(C2H5)Cl.
, который образуется и из диаллила(см., Бертело).] или с хлористым алюминием (Кёнлейн). Последний способ ведет к различным продуктам, смотря по темп., при которой происходит взаимодействие С nH2n+1 J с AlCl 3 [Нагревание производят в запаянных трубках, как при восстановлении С nH2n+1 J йодистым водородом . ]; всегда образуются при этом Парафины, и первоначально Парафины, отвечающий взятому йодангидриду, т. е. из йодистого бутила — бутан, из йодистого гексила — гексан и т. д., но высшие члены ряда (до пентана) под влиянием АlСl 3 и образующегося HJ претерпевают, около 125° — 140°, распадение, ведущее к образованию бутана, а этот последний в свою очередь, при температурах 160° — 225°, распадается, превращаясь в пропан; С 3 Н 8 в указанных условиях не изменяется (Лотар, Мейер и Клуге). Что касается восстановления йодистым водородом предельных кислот, то эта реакция применима только к получению высших Парафины, начиная с нормального нонана С 9 Н 20, т. е. с пеларгоновой кисл. (см.; Крафт): C nH2nO2 + 6HJ = CnH2n+2 + 2H2O = 3J2. Нагревают для этого в запаянных трубках 2—4 гр. кислоты с 3—4 ч. йодистоводородной кислоты (уд. в. 1,7) и 1/3 ч. фосфора [Прибавление фосфора облегчает ход реакции, так как в присутствии воды он превращает выделяющийся йод в йодистый водород 2P + 3J 2 + 6H2O = 2P(OH)3 + 6HJ. Фосфористая кислота претерпевает при этом отчасти дальнейшее изменение.] 3—5 часов при 210° — 249°; затем трубки вскрывают, прибавляют в них немного фосфора и снова греют при той же температуре; операцию повторяют раза 2—3; образованный Парафины перегоняют с водяными парами и нагревают с концентрированным едким кали (Крафт). Выход не особенно хороший и в этом отношении гораздо выгоднее восстановление йодистым водородом в тех же условиях кетонов, которые должны быть, однако, предварительно превращены — действием пятихлористого фосфора — в тела общей формулы С n Н 2nCl2 (см. Кетоны). К реакции образования Парафины из йодюров, при нагревании с водой и цинком (см. выше): 2С n Н 2n+1J + 2Zn + 2H2O = 2CnH2n+2 + ZnJ + Zn(OH)2, тесно примыкает реакция разложения цинкоорганических соединений водой; идет она очень энергично и дает чистые продукты: Zn(C 2H5)2 + 2H2O = 2C2H6 + Zn(OH)2 (Франкланд); меркурорганические соединения дают Парафины только при действии кислот: Hg(C 2H5) + HCl = C2H6 + Hg(C2H5)Cl.
Прямое соединение олефинов с водородом идет трудно (по Бертело около 500°) и не ведет потому к образованию чистых продуктов; для газообразных олефинов в присутствии платиновой черни оно возможно, впрочем, при обыкновенной температуре (ф. Вильде); жидкие и твердые олефины могут быть превращены в Парафины (?) нагреванием с йодистым водородом (Крафт). К числу нечистых реакций должна быть причислена и реакция образования Парафины при нагревании со щелочами (натристой известью, баритом) натриевых солей жирных кислот:
CH3—CO(ONa) + HONa = CH4 + CO(ONa)2, C6H12(CO2H)2 + 2Ba(OH)2 = C6H14 + 2BaCO3 + 2H2 O, так как одновременно с Парафины образуются кетоны (альдегиды?) и нек. другие продукты сухой перегонки [Кроме того, получаются иногда изомерные углеводороды; так, при перегонке энантовобариевой соли (см. Энантовая кислота) образуется не нормальный гексан, а симметричный диметилбутан (Риш).]; высшие жирные кислоты (их соли) даже совсем не образуют Парафины при перегонке с натристой известью; в этом случае (напр. для кислот миристиновой, пальмитиновой, стеариновой) могут быть, однако, получены хорошиe выходы Парафины, если натриевые соли этих кислот подвергнуть перегонке в пустоте с метилатом натрия CH 3 (ONa) (Май). При двухосновных кислотах реакция идет в две фазы, так как из себациновой кислоты можно получить нониловую, а из янтарной — пропионовую кислоты (Май). Отнятие галоида от двух молекул предельного йодюра и соединение остатков с образованием Парафины было одной из первых синтетических реакций для них. Франкланд (1848) нагревал для этого йодюр в запаянной трубке с цинком: 2C 2H5J + Zn = ZnJ2 + C4H10; удобнее идет реакция, если действовать натрием на йодюр (Вюрц), разбавленный в случае надобности безводным эфиром (или бензолом): 2C 2H5J + 2Na = 2NaJ + C4H10.
Если взята смесь двух йодюров, напр. йодистого этила и йодистого амила, то имеет место и такая реакция: C 2H5J + C5H11J + 2Na = C7H16 + 2NaJ; кроме того, понятно, образуются бутан C 4H10 и декан С 10 Н 22. Это, впрочем, не единственные продукты реакции; побочно, как и при способе Франкланда, образуются в небольшом количестве Парафины с меньшей частицей и олефины; так, при нагревании цинка с йодистым этилом наблюдаются, кроме бутана, этан и этилен: 2C 2H5J + Zn = ZnJ2 + C2H6 + C2H4. Реакция Франкланда несомненно протекает в несколько фаз: C 2H5J + Zn = C2H5—ZnJ, 2C2H5—ZnJ = (C2H5)2Zn + ZnJ2, (ср. Металлоорганические соединения) и (C 2H5)2Zn + 2C2H5J = ZnJ2 + 2C4H10; очень вероятно, что и при действии натрия на йодюры образуются промежуточные металлоорганические соединения: C 10H21J + 2Na = C10H21—Na2J, nC10H21—Na2J = (C10H21Na)n + nNaJ и, наконец, (C 10H21Na)n = (n/2)C20H42 + nNa; в пользу такого представления говорит (по мнению Крафта и Гёттига) покрытие натрия в начале реакции каким-то темно-синим кристаллическим веществом (по Бертело — соединение калия с нафталином, а по Абельянцу — соединение калия с бензолом представляют темно-синие, кристаллические вещества) и способность даже сравнительно стойких металлоорганических соединений, как напр. меркуралкилов, распадаться при нагревании (до 200°) на ртуть и Парафины: Hg(C 2H5)2 = Hg + C4H10 и Hg(C 8H17)2 = Hg + C16H34 (Эйхлер); нестойкость же натрорганических соединений явствует из невозможности получения их в чистом виде (без примеси цинкорганических соединений). Как на видоизменение только что описанного метода надо смотреть на реакцию галоидангидридов спиртов с готовыми цинкорганическими соедин., как напр.: (CH 3)2Zn + 2CH3J = ZnJ2 + 2C2H6 (Франкланд), CH 3—CCl2—CH3 + Zn(CH3)2 = ZnCl2 + C(CH3)4 (Львов), (CH 3)2CCl2 + Zn(C2H5)2 = ZnCl2 + (CH3)2—C—(C2H5)2
(Фридел и Ладенбург). Образование Парафины при электролизе солей жирных кислот открыто (Кольбе) почти одновременно с реакцией Франкланда; первым полученным таким образом Парафины был один из октанов: 2C 4H9—CO(OH) = C8H18 + 2CO2 + H2. Реакция имеет в настоящее время больше исторический интерес, так как получение при посредстве ее углеводородов затруднительно; Крум-Броуну и Уокеру удалось перенести ее на кислые эфиры двуосновных кислот и выработать элегантный, синтетический метод образования двуосновных же кислот с большей величиной частицы: 2C 2H5O—OC—CnH2n—CO(ONa) = C2H5O—OC—C2H2n—CnH2n—CO—OC2H5 + 2CO2 + 2Na. До известной степени реакцию Кольбе напоминает случай образования этана при нагревании перекиси ацетила с перекисью бария: CH 3—CO(O2)CO—CH3 = C2H6 + 2CO2 (Шютценбергер); образующийся здесь C 2H6 очень нечист (Дарлинг).
Парафины, содержащие от 1 до 4 атомов углерода, газообразны при обыкн. темп., затем до С 15 следуют жидкости, за которыми являются твердые тела с постепенно возрастающей точкой плавления. Судя по свойствам диметилпропана (см. ниже), должно думать, что и до С 15 некоторые углеводороды будут твердыми; так, по Львову и Храповицкому тетраметилбутан (гексаметилэтан)
кристалличен, плавится при 96° — 97° и кип. при 105° — 106°. Точка кипения Парафины одного строения быстро растет с увеличением частицы, так что высшие члены ряда способны перегоняться без разложения только под уменьшенным давлением; как всегда, частицы с нормальным строением (т. е. содержащие только два СН 3) обладают высшей точкой кипения и, по мере нарастания числа СН 3 в частице углеводорода, точка кипения его падает. Удельный вес Парафины растет сравнительно медленно; замечательно, что, начиная с С 11 Н 24 и дальше, уд. вес углеводородов, определенный при темп. их плавл., является почти постоянной величиной. В табл. в 1-м столбце стоит формула Парафины, во 2-м его название и фамилия автора, определившего приводимые свойства, в 3-м точки плавления, в 4-м точки кипения и в 5-м удельные веса
| СH 4 | Метан (Вроблевский, Ольшевский) | —186° | —164° | 0,415 (—161°) |
| С 2 Н 6 | Этан | газы: физические постоянные | ||
| С 3H8 | Пропан | не определены. | ||
| С 4 Н 10 | Бутан (Бутлеров) | — | +1° | — |
| Метилпропан (Бутлеров) | — | — 17° | — | |
| C5H12 | Пентан (Шорлеммер) | — | +37° | 0,627 (14°) |
| Диметилпропан (Львов) | —20° | +9° | — | |
| С 6 Н 14 | Гексан (Шифф, Брюль, Цандер) | — | 69° | 0,658 (20°) |
| Диметил-2-бутан (Горяинов) | — | 48° | — | |
| С 7 Н 16 | Гептан (Торпе, Шорлеммер) | — | 98° | 0,683 (20°) |
| С 8 Н 18 | Октан (Торпе) | — | 125° | 0,702 (20°) |
| С 9 Н 20 | Нонан (Крафт) | —51° | 150° | 0,718 (20°) |
| С 10 Н 22 | Декан (Крафт) | —31° | 173° | 0,730 (20°) |
| С 11 Н 24 | Гендекан [Чаще С 11 Н 24 называется ундеканом] (Крафт) | —26° | 195° | 0,774 (— 26°) |
| С 12 Н 26 | Додекан (Крафт) | —12° | 214° | 0,773 (— 12°) |
| С 13 Н 28 | Тридекан (Крафт, Май) | —6° | 234° | 0,775 (— 6°) |
| С 14 Н 30 | Тетрадекан (Крафт) | +4° | 252° | 0,775 (+4°) |
| С 15 Н 32 | Пентадекан (Крафт, Май) | +10° | 270° | 0,776 (+10°) |
| C20H42 | Эйкозан (Крафт) | 37° | 205° (15 мм) | 0,778 (37°) |
| С 21 Н 44 | Генэйкозан (Крафт) | 40° | 215° (15 мм) | 0,778 (40°) |
| С 22 Н 46 | Докозан (Крафт) | 44° | 224° (15 мм) | 0,778 (44°) |
| С 23 Н 48 | Трикозан (Крафт) | 48° | 234° (15 мм) | 0,779 (48°) |
| С 35 Н 72 | Пентатриаконтан (Крафт) | 75° | 331° (15 мм) | 0,782 (75°) |
| С 60 Н 122 | Гексаконтан (Гелль и Гегеле) | 101° — 102° | — | — |
Если отнести точки плавления нормальных Парафины к прямоугольным осям, принимая их за ординаты, а за абсциссы число атомов углерода в частицах, то получаются две гиперболических кривых; вышележащая обнимает собой точки плавления Парафины с четным числом атомов углерода, а нижележащая отвечает точкам плавления Парафины с нечетным числом атомов С [Подобная же правильность давно установлена Байером для точек плавления двухосновных предельных жирных кислот и в 1896 г. Массолем для точек плавления одноосновных предельных, нормальных жирных кислот.]. На точках кипения их можно подметить такую же правильность (Милльс), хотя и менее резко выраженную. Что касается малой изменяемости удельных весов высших Парафины, то она равносильна прямолинейной зависимости их удельных объемов от частичного веса. Все Парафины бесцветны, мало растворимы в воде; средние члены недурно растворимы в спирте и хорошо в эфире; высшие члены и в последнем трудно растворимы.
В химическом отношении Парафины характеризуются значительной индифферентностью; на холоде на них почти не действуют: крепкая серная кислота, крепкая азотная (ср. ниже образование нитросоединений), смесь обеих кислот, хромовая кислота и некоторые другие, так наз. "энергичные" реактивы. Впервые эти свойства были наблюдены в 1830 г. Рейхенбахом, выделившим смесь высших, твердых Парафины из продуктов сухой перегонки дерева, а потому он и дал ей название (считая добытое вещество однородным) "paraffin" (от лат. слов par um и аffinis), чтобы характеризовать "ее главное свойство, заключающееся в незначительности ее сродств"; впоследствии, когда стали известны низшие члены ряда, название Парафины было перенесено и на них Г. Уатсом. При нагревании крепкая азотная кислота и другие энергичные окислители разрушают Парафины, образуя в конце концов углекислоту и воду; побочными продуктами в небольшом количестве являются жирные кислоты, янтарные кисл. и некоторые другие окисленные вещества (см.). Слабая азотная кислота (уд. в. 1,036—1,075 при 120° — 140°) нитрует Парафины, образуя нитросоединения (М. Коновалов, XXI, 198). Хлор действует на Парафины под влиянием рассеянного света уже на холоде, образуя продукты замещения (см. Хлоропарафины); на прямом солнечном свете реакция метана с хлором может дойти до взрыва и продуктами ее являются уголь и хлористый водород: mСН 4 + 2mСl 2 = mC + 4mНСl; замещение водорода хлором в Парафины идет легко в присутствии небольшого количества йода и при нагревании; для СН 4, C2H6 и C 3H8 получены, кроме промежуточных, и продукты полного замещения водорода хлором, т. е. ССl 4, C2 Сl 6 и C 3 Сl 8; начиная с C 4H10 наблюдается при энергичном хлорировании распадение углеводорода (ср. выше об отношении Парафины к нагреванию их с АlСl 3) и продуктами его являются CCl 4, C2Cl6, C4Cl6 и C 6Cl6 (гексахлорбензол; Крафт и Мерц). До 1848 г. из Парафины был известен почти только один метан CH 4; в этом году Кольбе и Франкланд открыли образование Парафины (ср. выше) при электролизе солей жирных кислот и нагревании йодюров спиртов с цинком; полученные таким образом углеводороды были приняты за настоящие радикалы (см.) спиртов и этан С 2 Н 6 получил название метила-СН 3 и т. д. Жерар тогда же, руководствуясь законом Авогадро (см. Частичная гипотеза), высказался за удвоение их формул и за то, что открытые углеводороды являются гомологами (см. Гомология) метана; к тому же склонился и Гофман, опиравшийся на правильности в точках кипения гомологов, установленных ранее Коппом (см. Температуры кипения органич. соединений). Кроме "радикалов" Франкландом были еще получены углеводороды ряда С n Н 2n+2, которые он считал полимерными с первыми и, принимая их за настоящие гомологи СН 4, назвал водородистыми радикалами; таким образом принималось существование CH 3 ' — радикала метила и С 2 Н 5 (H) — водородистого этила. Тождество обоих рядов было установлено изучением их продуктов замещения. Бертело показал, что СН 3 Сl продукт замещения хлором 1 ат. водорода метана тождествен с хлористым метилом, получаемым из метилового спирта действием соляной кислоты: CH 3(OH) + HCl = CH3Cl + H2 O; затем целый ряд монохлоропродуктов Парафины и водородистых радикалов был изучен Шорлеммером, показавшим их полное тождество; в особенности решающее значение имело наблюдение, что как из "метила", так и из водородистого этила получается один и тот же хлористый этил C 2H5 Cl (Шорлеммер), переходящий при нагревании с водой в винный спирт (Бутлеров); почти одновременно (годом раньше) было установлено, что "этил" C 2H5 ' Франкланда при действии хлора дает хлористый бутил — С 4 Н 9 Сl (Шейен). О тождестве хлористого метила см. Хлористый метилен).
Все Парафины делятся по строению на нормальные общей формулы: СН 3 —(СH 2)n —СН 3 и остальные, содержащие больше метильных групп и для которых нет общепринятых классов [По Роско и Шорлеммеру, остальные Парафины делятся на "изо" Парафины — с тремя метиловыми группами, "мезо" Парафины напр. (СН 3)2 CH—CH(СН 3)2 и (СН 3)2 СН—СН(СН 3)—СН 2 —СH(CH 3)2 и "нео" Парафины — напр. С(СН 3)4 и т. д. Эта классификация не получила права гражданства.].
Число возможных изомеров с нарастанием числа атомов С в частице быстро увеличивается, как видно из следующей таблички (Кейлей, Германн):
| Число атомов С | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 и т. д. |
| " возм. изомеров | 1 | 1 | 1 | 2 | 3 | 5 | 9 | 18 | 35 | 75 | 159 | 355 | 802 и т. д. |
Надо заметить, что при составлении этой таблицы не принята во внимание "оптическая" ("геометрическая", см. Стереохимия) изомерия Парафины, а она несомненно возможна, как видно из того, что несколько оптически деятельных Парафины теперь уже известны, напр. CH 3—CH(C2H5)—СН 2 —СH 2 —СН 3, для которого [α] = +3,93° (Юст), СН 3 —СН(С 2 Н 5)—СН 2 —СH 2 —СН(С 2H5)—СН 3 с [α] = +8,69° (Юст) и т. д.; если же принять во внимание возможность оптически деятельных Парафины и вероятность их "рацемических" (см. Винная кисл.) форм, то число возможных изомеров должно еще возрасти. В сравнении с этими громадными числами количество известных Парафины ничтожно.
В заключение несколько слов о современной номенклатуре Парафины, выработанной женевским конгрессом 1892 г. Названия всех Парафины, как давно предложено Гофманом, оканчиваются слогом "ан" и для "нормальных" Парафины они следующие: метан — СН 4, этан — С 2 Н 6, пропан — С 3 Н 8, бутан — C 4H10; начиная с C 5H12, название составляется из греч. числительного и слога "ан", напр. C 5H12 — пентан, C 6H14 — гексан и т. д. (см. выше табл.). Парафины не нормального строения рассматриваются как продукты замещения нормальных, остатками каковых считаются наиболее длинные углеродные цепи; напр. 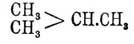 есть метилпропан (ранее был назван Бутлеровым изобутаном), а
есть метилпропан (ранее был назван Бутлеровым изобутаном), а  — диметилпропан (тетраметилформен Львова). Когда замещающая группа находится в боковой цепи, то вместо метила, этила и т. д. говорят мето-, это- и так далее, например
— диметилпропан (тетраметилформен Львова). Когда замещающая группа находится в боковой цепи, то вместо метила, этила и т. д. говорят мето-, это- и так далее, например  есть метоэтилгептан. Положение боковой цепи указывается цифрой, которой обозначен углеродный атом главной цепи, причем счет ведется с конца более близкого к наиболее простой замещающей группе; напр.
есть метоэтилгептан. Положение боковой цепи указывается цифрой, которой обозначен углеродный атом главной цепи, причем счет ведется с конца более близкого к наиболее простой замещающей группе; напр.  есть метил-3-гексан, и
есть метил-3-гексан, и  есть метил-3-этил-4-гексан. Углеродные атомы боковых цепей обозначаются цифрой углеродного атома главной цепи, к которой он примыкает; эта цифра снабжается показателем, напр.
есть метил-3-этил-4-гексан. Углеродные атомы боковых цепей обозначаются цифрой углеродного атома главной цепи, к которой он примыкает; эта цифра снабжается показателем, напр.  .
.
Когда с одним углеродным атомом соединены две замещающих группы, то простейшая называется первой; напр. 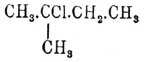 есть 2-метил-2-хлорбутан.
есть 2-метил-2-хлорбутан.
А. И. Горбов. Δ.
|
Смотрии так же... |
|