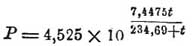Пар (физ.-хим.)*
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| П | ПЕ | ПА | ПЕ | ПЁ | ПЖ | ПИ | ПЛ | ПН | ПО | ПП | ПР | ПС | ПТ | ПУ | ПФ | ПХ | ПЧ | ПШ | ПЫ | ПЬ | ПЭ | ПЮ | ПЯ |
| ПАА |
| ПАБ |
| ПАВ |
| ПАГ |
| ПАД |
| ПАЕ |
| ПАЖ |
| ПАЗ |
| ПАИ |
| ПАЙ |
| ПАК |
| ПАЛ |
| ПАМ |
| ПАН |
| ПАО |
| ПАП |
| ПАР |
| ПАС |
| ПАТ |
| ПАУ |
| ПАФ |
| ПАХ |
| ПАЦ |
| ПАЧ |
| ПАШ |
| ПАЭ |
| ПАЮ |
| ПАЯ |
Пар (физ.-хим.)* — Обыкновенно под словом Пар понимают лишь газообразное состояние тела при температурах ниже критической, называя это состояние при температурах выше критической — газом этого тела. Парообразование совершается с поверхности не только жидких, но и твердых тел; так, напр., снег и лед сильно испаряются даже при весьма низких температурах; существует даже целый ряд тел (камфара, нашатырь), которые всецело переходят в Пар — возгоняются, совершенно не переходя из твердого состояния в жидкое (объяснение этого явления см. Испарение). Обыкновенно же парообразование, незаметное в твердом теле, усиливается при переходе тела в жидкое состояние и в последнем сильно возрастает при повышении температуры. Механизм этого явления см. Испарение; там же см. Явления, сопровождающие испарение. При некоторой определенной температуре — темп. кипения (см.), зависящей от внешнего давления на тело, парообразование начинается во всей массе тела и при достаточном притоке тепла извне к телу продолжается до тех пор, пока все тело не перейдет в Пар Увеличивая внешнее давление, можно повышать температуру кипения, но лишь до определенного предела — критической температуры (см.), выше которой тело при всяком давлении может существовать лишь в газообразном виде. Если поместить вещество в замкнутом пространстве при постоянной температуре, то образующийся из него Пар будет мало-помалу заполнять пространство и, представляя газообразное тело, будет производить определенное давление на стенки сосуда и на вещество; это давление будет, согласно закону Дальтона, прилагаться к тому давлению, которое производят уже находящиеся в названной замкнутой оболочке другие газы, напр. воздух. По мере увеличения количества выделившегося П будет расти и производимое им давление, а следовательно, и его упругость, но лишь до известного предела, после которого дальнейшее выделение Пар прекращается (но не парообразование, см. Испарение). Опыты показали, что при данной температуре выделение Пар прекращается, независимо от сосуда и других наполняющих его газов, тогда, когда упругость Пар достигла определенной величины, которую называют упругостью Пар данного вещества, насыщающего пространство при данной температуре, или, сокращенно, упругостью насыщенного Пар данного вещества при данной температуре. Разные вещества при одной и той же температуре имеют различнейшие упругости Пар, насыщающего и пространство, как видно из следующей таблицы:
Упругость паров, насыщающих пространство (в миллиметрах ртутного столбца), для температуры 20°С
| Ртуть | 0,0013 |
| Вода | 17,36 |
| Алкоголь | ,0 |
| Хлороформ | 160,5 |
| Сернистый углерод | 198,5 |
| Эфир | 442,4 |
| Сернистая кислота (SO 2) жидкая | 2162 (3,24 атм.) |
| Хлор жидкий | 5798 (7,63 ") |
| Аммиак жидкий | 6384 (8,4 ") |
| Углекислота жидкая | 44688 (58,8 ") |
От упругости Пар зависит "летучесть" данного вещества при данной температуре и скорость его испарения. Зависимость упругости Пар от температуры у разных тел различная, но у всех упругость растет с температурой, как видно, напр., из следующей таблицы:
Изменение упругости нас. Пар с температурой (упругости даны в миллиметрах ртутного столба).
I — Серный эфир, II — аммиак жидкий в атм.
| Темп. | Ртуть | Вода | I | II |
| 0 | 0,00019 | 4,569 | 184,9 | 4,19 |
| 25 | 0,0020 | 23,517 | 361,0 | 9,84 |
| 50 | 0,013 | 91,978 | 1276,0 | 19,95 |
| 75 | 0,071 | 288,764 | 2991 (80°C) | 36,35 |
| 100 | 0,285 | 760,000 | 4859 | 61,32 |
| 125 | 1,10 | 1743,88 | 7495 (120°C) | — |
| 150 | 2,93 | 3581,23 | 13281 | — |
Особенный интерес представляет упругость насыщенных Пар воды, так как содержание Пар воды определяет степень влажности (см.) окружающего воздуха, и так как эти Пар применяются в паровых машинах. Вопрос о зависимости упругости Пар воды от температуры изучен был в особенности Магнусом (1844) и Реньо (1843) и привел к результатам (по Реньо), помещенным в таблице в ст. Вода.
Кирхгоф показал в 1858 г. теоретически, что при температуре перехода тела из твердого состояния в жидкое, упругость Пар твердого тела и жидкого должна быть одинаковой; так, напр., при 0° упругость Пар воды и льда равны 4,60 мм. Позже (1882) Герц указал на то, что у переохлажденной жидкости (т. е. у жидкости, искусственно охлажденной ниже ее температуры замерзания) упругость Пар всегда должна быть больше, чем у твердого тела (застывшей жидкости) при той же температуре; это было вполне подтверждено опытами Рамзая и Юнга (1887), Фишера (1886) и Юдина (1893) над упругостью Пар воды и льда. Так, напр., при 10° упругость Пар переохлажденной воды (по Юлину) = 2,191 мм, а льда = 1,997 мм.
Некоторые соображения и опыты дают возможность предполагать, что и у твердых тел существует упругость Пар, насыщающих пространство, растущая с температурой. Этот вопрос, однако, еще весьма мало разработан; определенные данные существуют лишь для камфары (Рамзай и Юнг, 1887).
Упругость паров камфары (по Рамзаю и Юнгу) в мм ртутного столба.
| Темп. | Упругость |
| 41° 2 | 1,7 |
| 48,9 | 7,2 |
| 92,4 | 15,4 |
| 101,0 | 27,2 |
| 109,4 | 35,0 |
| 127,4 | 66,3 |
| 136,3 | 92,8 |
| 140, 3 | 105,0 |
| 147,0 | 155,1 |
| 154,3 | 197,6 |
| 168,0 | 297,8 |
Температура кипения жидкости — та температура, при которой упругость Пар ее, насыщающего пространство, равна внешнему давлению (см. Кипение). Отсюда мы заключаем, что темп. кипения зависит от внешнего давления [О влиянии нa температуру кипения стенок сосуда — см. Кипение.] и что, напр., вода кипит при 100° лишь при давлении барометра в 760 мм, так как при 100° упругость Пар ее равна 760 мм. Температура кипения воды при различных давлениях между 700 и 800 мм, а следовательно, и упругость Пар воды при этих температурах даны в следующей таблице.
Температура кипения воды при давлениях от 700 до 800 мм рт. столба.
| Давл. | Темп. | Давл. | Темп. | Давл. | Темп. | Давл. | Темп. |
| 700 | 97,72 | 701 | 76 | 702 | 80 | 703 | 84 |
| 704 | 88 | 705 | 92 | 706 | 96 | 707 | 99 |
| 708 | 98,03 | 709 | 07 | 710 | 11 | 711 | 15 |
| 712 | 19 | 713 | 23 | 714 | 27 | 715 | 31 |
| 716 | 34 | 717 | 38 | 718 | 42 | 719 | 46 |
| 720 | 50 | 721 | 54 | 722 | 57 | 723 | 61 |
| 724 | 65 | 725 | 69 | 726 | 98,73 | 727 | 77 |
| 728 | 80 | 729 | 84 | 730 | 88 | 731 | 92 |
| 732 | 96 | 733 | 99 | 734 | 99,03 | 735 | 07 |
| 736 | 11 | 737 | 14 | 738 | 18 | 739 | 22 |
| 740 | 26 | 741 | 30 | 742 | 33 | 743 | 37 |
| 744 | 41 | 745 | 44 | 746 | 48 | 747 | 52 |
| 748 | 56 | 749 | 59 | 750 | 63 | 751 | 67 |
| 752 | 99,73 | 753 | 74 | 754 | 78 | 755 | 82 |
| 756 | 85 | 757 | 89 | 758 | 93 | 759 | 96 |
| 760 | 100,00 | 761 | 04 | 762 | 07 | 763 | 11 |
| 764 | 15 | 765 | 18 | 766 | 22 | 767 | 26 |
| 768 | 29 | 769 | 33 | 770 | 36 | 771 | 40 |
| 772 | 44 | 773 | 47 | 774 | 51 | 775 | 55 |
| 776 | 58 | 777 | 62 | 778 | 100,65 | 779 | 69 |
| 780 | 73 | 781 | 76 | 782 | 80 | 783 | 83 |
| 784 | 87 | 785 | 90 | 786 | 94 | 787 | 98 |
| 788 | 101,01 | 789 | 05 | 790 | 08 | 791 | 12 |
| 792 | 15 | 793 | 19 | 794 | 22 | 795 | 26 |
| 796 | 30 | 797 | 33 | 798 | 37 | 799 | 40 |
| 800 | 44 | 801 | 47 | 802 | 50 | 803 | 53 |
Нижеследующая таблица дает температуры кипения при давлении барометра в 760 мм для некоторых веществ.
Температуры кипения.
| Эфир | 84,9°C |
| Сернистый углерод | 46,2° |
| Алкоголь | 78,4° |
| Бензол | 80,4° |
| Вода | 100° |
| Тол | 175° |
| Анилин | 184° |
| Фосфор | 213° |
| Ртуть | 357° |
| Сера | 447,5° |
| Цинк | 930° |
Под весьма сильными давлениями можно нагреть жидкость значительно выше ее нормальной температуры кипения; напр., под давлением в 10 атмосфер вода закипает лишь при температуре в 180°, а под давлением в 20 атмосфер лишь при 215°. По причине этого вода в паровых котлах обыкновенно перегрета выше 100°; на этом же основано устройство Цапинового котла (см.). Увеличивая давление, мы можем довести вещество в жидком состоянии до критической температуры, при которой оно внезапно все превратится в газ, так как выше ее возможно существование данного вещества лишь в виде газа.
Из сказанного следует, что для определения упругости Пар, насыщающих пространство при данной температуре, можно: 1) либо определять давление, под которым при данной темпер. жидкость кипит, либо 2) дать образоваться в замкнутом пространстве при данной темп. насыщающему это пространство количеству Пар данной жидкости и измерить манометром избыток давления, производимые им исследования, произведенные по этим двум методам, показали: 1) что определенной закономерной зависимости между температурой и соответствующей ей упругостью нас. Пар для всех жидкостей найти при настоящем положении науки нельзя. Посему ограничиваются составлением на основании результатов опытов эмпирических формул, связующих темп. с упругостью насыщенного Пар Так, напр., для воды дан был целый ряд формул Августом (1828), Реньо (1843) и другими. Формула Августа, дающая в пределах 0°—100° результаты весьма близкие к результатам опыта, следующая:
Приводим еще (по Цейнеру) формулы для упругости Пар эфира, хлороформа и ртути: если выражать температуру t в градусах Цельсия, а упругость Р в мм ртутного столба то ход изменения Р можно выразить формулой
logP = a + b α t + c β t
Для эфира logP = 5,0286298 — bα t + c β t
где log(bα t) = 0,4414317 — 0,0031223t
log(c β t) = 0,6502970 — 4 + 0,0145775t
Для хлороформа logP = 5,2253893 — bα t — c β t
где log(bα t) = 0,5219943 — 0,0025856t
log(c β t) = 0,888617 — 1 — 0,0131824t
Для ртути logP = 5,6640459 — bα t + c β t
где log(bα t) = 0,890208 — 0,0012438t
log(c β t) = 0,5820395 — 1 — 0,0119062t
Подробные данные об упругости паров воды при разных температурах и плотности и удельном объеме водяных паров см. Zeuner, "Technische Thermodynamik" (т. II).
2) Упругость насыщенного Пар сильно зависит от чистоты жидкости; небольшая примесь растворенного в ней другого тела заметно влияет на упругость насыщенного Пар Это явление изучено особенно внимательно для растворов солей. Приводимая таблица дает, как пример, упругости Пар растворов едкого кали в воде для нескольких концентраций и нескольких температур.
Содержание едкого кали в растворе в %.
| Темп.°С | 0% | 10% | 20% | 30% | 40% | 49% |
| 10° | 9,17 | 8,62 | 8,01 | 7,31 | 6,50 | 5,62 |
| 16° | 13,54 | 12,74 | 11,85 | 10,82 | 9,62 | 8,33 |
| 21° | 18,50 | 17,42 | 16,22 | 14,82 | 13,20 | 11,44 |
| 26° | 24,99 | 23,55 | 21,94 | 20,07 | 17,89 | 15,53 |
| 31° | 33,41 | 31,51 | 29,38 | 26,91 | 24,03 | 20,91 |
| 33° | 37,41 | 35,30 | 32,93 | 30,18 | 26,97 | 23,50 |
Новейшая теория растворов (см.) дали возможность теоретически вывести замечательную зависимость между упругостью насыщенного Пар растворителя р0 и раствора р для слабых растворов тел, не имеющих заметной упругости Пар Если на 100 молекул растворителя приходится N молекул растворенного вещества, то, как показал Рауль (1888),
(p0 — p)/p0 — KN,
где K должно, по теории, равняться 0,01 и не должно зависеть от вещества растворителя. Опыты показали, что эта зависимость подтверждается при слабых растворах для большинства растворенных тел — не солей; для солей же K больше, что зависит от разложения соли в растворе (на ионы; см. Растворы). Упругость Пар смеси двух жидкостей (р), имеющих каждая свою упругость насыщенного Пар (p1 и р 2), обыкновенно (но не всегда) лежит между p1 и р 1; смеси жидкостей изучены были в этом отношении особенно подробно Д. Пар Коноваловым (см. Кипение). Теоретические исследования на почве механической теории тепла показали, что упругость насыщенных Пар должна зависеть еще от некоторых обстоятельств, а именно: 1) от формы поверхности, над которой Пар образуется. Томсон (1871) первый показал, что над выпуклой поверхностью упругость Пар всегда должна быть больше, чем над плоской, над вогнутой меньше; этот вывод был подтвержден опытами Винкельмана. Разница эта весьма невелика; напр. над каплей воды в 0,1 мм радиусом упругость Пар лишь на 0,01 мм ртутного столба больше нормальной. Несмотря на эту небольшую разницу, явление это играет, по-видимому, значительную роль в природе; оно объясняет конденсацию мельчайшей водяной пыли в большие капли дождя. 2) От электризации поверхности жидкости упругость Пар над ней понижается (весьма незначительно). Это явление может послужить для объяснения большого размера дождевых капель из грозовых облаков. Эти указанные два случая изменения упругости насыщенных Пар являются, как показал проф. Пар А. Шиллер (1895), частными случаями, подчиненными общему закону, гласящему, что упругость насыщенного Пар увеличивается, когда на поверхность раздела жидкости и Пар прилагается давление, направленное вовнутрь жидкости, и уменьшается, когда это давление направлено вовнутрь Пар; по той же причине, как показал проф. Шиллер, упругость насыщенного Пар жидкости, находящейся в среде газа под большим давлением, больше нормальной (в пустоте); таким образом, давление, приложенное к поверхности раздела Пар и жидкости, как бы выдавливает из последней пары.
Если некоторый объем, насыщенный при данной температуре паром, нагреть, то Пар будет перегретый и не насыщающий пространство, потому что при более высокой температуре для насыщения данного объема потребовалось бы большее количество Пар То же самое произойдет, если при постоянной температуре увеличить объем, занимаемый П; его будет недостаточно для насыщения пространства, кроме того, он будет при более высокой температуре, чем та, при которой то же количество Пар могло бы насытить этот больший объем, а следовательно, может быть назван перегретым. Чем больше Пар перегрет и не насыщает пространство, тем больше он подобен газу и тем больше следует основным законам газов — закону Бойля-Мариотта и закону Гей-Люссака; наоборот, по мере приближения к условиям насыщения, отступления Пар от следования указанным законам будут делаться все заметнее, а именно: произведение из давления на объем не будет величина постоянная, но будет непрерывно уменьшаться по мере приближения к насыщению, а коэффициент расширения (при постоянном давлении; см. Газы), равный в сильно перегретом Пар коэффициенту расширения газа (0,00366), по мере приближения к насыщению Пар будет быстро расти. В приводимой ниже таблице даны средние коэффициенты расширения водяного пара в различных температурных пределах.
Средние коэффициенты расширения (при пост. давлении) водяного пара.
| От 0° до 118° | 0,004187 |
| " 0° " 141° | 0,004189 |
| " 0° " 162° | 0,004071 |
| " 0° " 200° | 0,003938 |
| " 0° " 246° | 0,003799 |
(коэффициент расширения газов равен 0,00366).
Плотностью Пар сильно перегретых и не насыщающих пространство, подобно плотности газов, называется отношение веса некоторого объема данного Пар к весу одинакового объема воздуха, находящегося при тех же условиях температуры и давления, что и Пар; плотность ненасыщенного Пар может считаться не зависящей от температуры и упругости настолько, насколько Пар эти следуют законам Бойля-Мариотта и Гей-Люссака и насколько они при этом не претерпевают химических изменений. По мере приближения к условиям насыщения пространства плотность Пар растет и при насыщении достигает наибольшей величины, называемой плотностью насыщенного Пар В нижеследующей таблице даны плотности Пар, далеких от насыщения, для некоторых тел.
Плотность паров различных веществ (отнесены к воздуху при тех же условиях).
| Хлор | 2,45 |
| Йод (250°— 600°) | 8,78 |
| Бром | 5,40 |
| Мышьяк | 10,36*) |
| Фосфор (300°—1000°) | 4,39 |
| Ртуть | 6,93 |
| Сера (выше 800°) | 2,21**) |
| Эфир | 2,56 |
*) Это число отвечает темп. краснокалильного жара и ниже, при 1714°—1736° плотность Пар мышьяка почти вдвое меньше (см. Мышьяк).
**) При 450°—700° плотность Пар серы 6,6 (см. Сера).
Пар вещества, достаточно далекий от насыщения, представляет данное вещество в газообразном состоянии; в этом состоянии вещество должно следовать закону Авогадро — в одинаковых объемах газов заключается одинаковое количество молекул, — а следовательно, плотность Пар должна быть пропорциональна весу молекул, или молекулярному весу вещества. Определение плотности II. далекого от насыщения представляет, таким образом, удобный способ определения молекулярного веса вещества и часто применяется для этой цели в химии (см. ниже).
Определение плотности насыщенного Пар с удовлетворительной точностью в первый раз произведено было Ферберном и Тэтом (1861). Эти определения представляют интерес в том отношении, что позволяют проверить выводимую в механической теории тепла зависимость
V = v + EL/[T(dp/dT)]... A
где V удел. объем насыщенного Пар (объем единицы веса), v удельный объем жидкости, L — скрытая теплота парообразования, Т абсолютная температура, dp/dT — изменение давления р с изменением температуры T, E — механический эквивалент тепла (425 кг м). Опыты Гервига (1869), Вюлльнера (1880), Перо (1888) и Бателли (1893) вполне подтвердили эту зависимость. Так, напр., для насыщенного водяного Пар при 760 мм и 100° формула дает объем одного килограмма Пар равным V = 1,6534 куб. м; объем одного килограмма воздуха при тех же условиях равен 1,0565 куб. м; следовательно, плотность водяного Пар равна 1,0565/1,06584 = 0,6390. Перо же из опыта нашел при 99,6°C V = 1,657, что дает плотность 0,6386, т. е. очень близкий результат.
Если имеющийся при некоторой температуре некоторый объем Пар, насыщающего пространство, охладить до темп. t', которая меньше t, то явится избыток Пар, который осядет в виде капель жидкости; то же самое произойдет, если при постоянной темп. уменьшить объем, занимаемый Пар (сжать Пар). Даже Пар, не насыщающий пространство, при понижении его температуры можно довести до насыщения, после чего при дальнейшем понижении температуры он будет оседать в виде капель. Температура, при которой Пар начнет оседать в виде капель, называется температурой росы, его упругость равна упругости насыщенного Пар при температуре росы. Этими данными пользуются при определении количества влаги в воздухе (см. Влажность, Гигрометры). В последнее время (1895) Кантор указал на то, что температура росы при данных условиях зависит от поверхности, на которую Пар оседает: она выше на поверхности, смачиваемой данной жидкостью, чем на поверхности, не смачиваемой ею.
На образование Пар из жидкости — на разъединение частиц жидкости — требуется некоторая работа, которая доставляется обыкновенно жидкости, при испарении ее, в виде тепла. Это тепло притекает к жидкости либо извне (когда мы испаряем жидкость, нагревая ее), либо когда внешнего притока тепла нет, берется из самой жидкости, при чем жидкость охлаждается. Напр. все тепло, притекающее к кипящей на огне воде, имеющей 100°С, идет на образование Пар, и потому темп. воды во все время кипения не повышается; эфир, испаряющийся на воздухе, охлаждается вследствие испарения. Количество тепла, выраженное в калориях, необходимое для того, чтобы один килограмм жидкости перевести в Пар при той же температуре, называется (скрытой) теплотой парообразования. В приводимой ниже таблице дана абсолютная температура кипения (температура по шкале Ц. + 273, напр. для воды 100 + 273 = 373) Т и теплота парообразования L для ряда веществ.
Теплота парообразования
| Т | L | М | ML/T | |
| Вода H 2O | 373,0 | 536,0 | 18 | 25,8 |
| Бензол С 6H6 | 853,0 | 92,9 | 78 | 20,5 |
| Хлороформ СНС l3 | 333,9 | 58,5 | 119 | 20,9 |
| Сероуглерод CS 2 | 319,1 | 83,8 | 76 | 20,0 |
| Ртуть Hg | 623,0 | 62,0 | 200 | 19,9 |
| Сера S | 589,0 | 862,0 | 82 | 19,6 |
Троутон (1884) указал на замечательную зависимость между молекулярным весом тел М, их абсолютной температурой кипения Т и теплотой парообразования L, а именно на то, что произведение ML/T есть величина для всех тел постоянная, близкая к 20, что и видно приблизительно из вышеприведенной таблицы. С повышением температуры почти у всех жидкостей теплота парообразования уменьшается. Так, напр., у воды (по данным Реньо) зависимость между температурой t и теплотой L выражается между 0° и 200° формулой
L = 589—0,3997t — 0,00124642,
что дает:
Теплота парообразования воды.
| Темп. | L | Темп. | L | Темп. | L |
| 0° | 589 | 75° | 552 | 150° | 501 |
| 25° | 578 | 100° | 547 | 175° | 481 |
| 500 | 566 | 125° | 520 | 200° | 459 |
Зависимость L от температуры может быть определена и теоретически, по приведенной выше формуле (А).
Свойства паров. Мы уже рассматривали коэффициент расширения Пар, уменьшающийся по мере удаления от температуры насыщения и приближающийся постепенно к коэффициенту расширения газов 0,00366. Теплопроводность Пар, как и газов, весьма незначительна; это наглядно следует из опытов над сфероидальным состоянием (см.). Определение теплоемкости (см.) ненасыщенных Пар производится как и определение теплоемкости газов, причем определяется теплоемкость при постоянном давлении (см. Газ). Работы Реньо (1862) н Е. Видемана (1876) показали, что теплоемкость Пар меньше, чем теплоемкость соответствующих жидкостей, причем отношение теплоемкости жидкости к теплоемкости Пар у большинства жидкостей равно приблизительно 1,7. С повышением температуры теплоемкость Пар, как и жидкостей, повышается, причем приблизительно в той же мере, как и жидкостей. Если выражать теплоемкость жидкости через C1, пара через С 2, а зависимость их от температуры формулой
C1 = C01 + a1t,
C2 = C02 + a2t,
то нижеследующая таблица дает (по Е. Видеману) эти величины для различных жидкостей.
Теплоемкость жидкостей и их паров (по Е. Видеману).
| Хлороформ | Серн. углерод | Эфир | Бензин. | |
| Пар | 0,1341 + 0,0000677t | 0,1315 + 0,0000963t | 0,3725 + 0,0004268t | 0,2237 + 0,0005114t |
| Жидкость | 0,2323 + 0,0000507t | 0,2352 + 0,0000815t | 0,5290 + 0,0002958t | 0,3798 + 0,0007200t |
Клаузиус (1850) ввел еще понятие о теплоемкости насыщенного Пар. т. е. о том количестве тепла, которое нужно придать единице массы насыщенного Пар, чтобы нагреть его на 1°, если в то же время настолько Пар сжимать, чтобы сохранить его насыщенным. Теоретическое исследование этой теплоемкости привело к результату, что она может быть как положительной, так и отрицательной, т. е. что количество работы, необходимое для того, чтобы настолько сжать нагретый Пар, чтобы он снова пришел к состоянию насыщения, может быть, будучи превращено в эквивалентное количество тепла, больше тепла, приданного Пар для его нагревании и меньше его. Прямым следствием отсюда является, что насыщенный Пар, обладающий положительной теплоемкостью, будучи быстро [Чтобы не было извне притока или оттока тепла.] сжат, частью осядет в виде жидкости — и перегреется, будучи быстро разрежен; насыщенный Пар, обладающий отрицательной теплоемкостью, наоборот, будучи быстро сжат, перегреется, а будучи быстро разрежен, осядет в виде росы. Теплоемкость насыщенных Пар воды отрицательная, у эфира она положительная. Вероятно, у всех веществ есть температура, при которой теплоемкость насыщенных Пар их меняет знак; такая перемена знака наблюдалась у хлороформа при 140° и у бензина при 115°. Оптические свойства Пар весьма близки к таковым же свойствам газов; коэфф. преломления их при нормальном давлении весьма, мало отличается от единицы; наибольший у Пар сернистого углерода — около 1,0015. Светорассеяние Пар весьма незначительное, и до 1865 г. даже сомневались в его существовании; некоторые Пар, напр. Пар йода, обладают аномальным светорассеянием (см.). Электропроводность у Пар весьма малая и, по-видимому, электролитическая, т. е. основана на разложении молекул Пар; это подтверждается наблюдением, что одноатомные Пар, напр. Пар ртути, не проводят электричества; этот сложный вопрос еще мало разработан. Диэлектрическая постоянная Пар близка к единице и не вполне следует закону Максвелла, по которому диэлектрическая постоянная тела должна быть пропорциональна квадрату коэфф. преломления света этим телом. Вообще можно сказать, что свойства Пар сильно зависят от степени их перегретости и в сильно перегретых Пар приближаются к свойствам газов, в насыщенных же Пар заметно от них отличаются.
А. Гершун.
Определение плотности Пар играет большую роль в химической практике, так как оно служит одним из важнейших способов для нахождения молекулярного веса химических соединений. Закон Авогадро-Жерара гласит что для тел в парообразном состоянии при одних и тех же условиях в равных объемах заключается равное число частиц, так что частичные веса различных тел относятся, как плотности их Пар Определение плотности Пар вещества, указывая его частичный вес, дает возможность, пользуясь данными для его процентного состава, определить его химическую формулу. Требуется только, чтобы определение плотности Пар производилось в таких условиях, в которых вещество не претерпевало бы никаких химических изменений и являлось со своими нормальными свойствами. Определение плотностей Пар производится вообще при атмосферном давлении и при температурах, которые на 20°—30° выше темпер. кипения исследуемого вещества, чтобы быть уверенным, что оно все обратилось в Пар; но в некоторых случаях полезно бывает производить определение плотности Пар при низшем давлении и темпер., напр. для веществ труднолетучих и от нагревания разлагающихся; иногда полезно делать это в присутствии других веществ, напр. когда к веществу диссоциирующему примешивается заранее один из продуктов его распада для уменьшения его разложения и пр. Все многочисленные способы определения плотности Пар можно разделить на две категории: в одной определяется, какой объем занимает в Пар при данных условиях известное количество вещества, напр. способы В. Мейера, Гофманна, Гей-Люссака и пр. В другой отыскивается вес вещества в Пар, при данном объеме, напр. способ Дюма. Наибольшим распространением пользуется способ В. Мейера. Хотя по точности он, может быть, и уступает способу Дюма, но необыкновенная простота и легкость выполнения делают его незаменимым в лабораториях.
Способ В. Мейера основывается на том, что вещество, быстро обращаясь в Пар в сосуде, наполненном каким-либо нагретым газом, вытесняет объем его, равный объему своего Пар при данных условиях темп. и давления. Если известен вес обращенного в Пар вещества s и измерен объем вытесненного газа, то стоит только вычислить вес последнего g, и получатся все данные для вычисления искомой плотности пара
Δ /d = s/g
где d плотность газа. Как видим, знать температуру среды, при которой вещество обратилось в Пар, и давление, в ней господствующее, — излишне, лишь бы эта величина не изменилась в течение опыта, что при его кратковременности достичь очень легко. Все это представляет громадное преимущество этого способа перед другими. Прибор В. Мейера (ф. 1) состоит из тонкостенного цилиндра b, около 200 куб. см емкости, с длинной (около 600 мм) стеклянной трубкой около 4 мм диам.
Фиг. 1. Прибор Мейера.
Трубка имеет в верхней части две боковых трубочки h и i; одна из них, капиллярная i, соединенная каучуком с f, служит для выхода газа; в другой h устроено приспособление для бросания в известный момент вещества в цилиндр. Оно состоит из стеклянной палочки с, вставленной в трубочку на каучуке d; палочка немного не доходит до стенок трубки. Если ввести в трубку b небольшую ампулку с веществом, то палочка не даст ей упасть вниз; если же оттянуть палочку назад, пользуясь эластичностью каучука, то ампулка провалится вниз. Чтобы она не разбила цилиндра, на дно его кладут немного асбеста. Цилиндр на пробив вставляется в особую стеклянную муфту a; в ней налита жидкость, кипячение которой служит для нагревания цилиндра; муфта делается такой высоты, что Пар кипящей жидкости сгущаются в ее верхней части и стекают обратно, так что не требуется особого холодильника; муфта укрепляется в обыкновенном железном штативе. Для нагревания прибора берутся жидкости с постоянной темпер. кипения; при этом наблюдают, как уже сказано, чтобы темпер, кипения взятой жидкости на 20 — 40° была выше темп. исследуемого вещества. Чаще всего применяются вода — темп. кип. 100°, ксилол — 140°, анилин — 183°, бензойноэтиловый эфир — 213°, тимол — 230°, бензойноамиловый эфир — 261°, дифениламин — 310°, сера — 448°, пятисернистый фосфор — 530°. Вещества жидкие берутся в ампулках — стеклянных тонкостенных шариках с одним или двумя отростками (они выдуваются из стеклянных трубок). Вещество вводится в ампулки простым насасыванием или, если ампулки с одним отростком, нагреванием и охлаждением ее (погрузив отросток ее в жидкость), как при наполнении термометров. Наполнив ампулку, отростки ее отпаивают. Взвешивая ее до наполнения и после, определяют количество взятого вещества. Стараются, чтобы ампулка была совершенно полна, тогда она легче лопается при нагревании. Вещества твердые берутся в кусочках или в виде палочек, в стеклянных трубочках с притертыми пробками, или, наконец, в трубочках из сплава Вуда и пр. Навески должны быть такие, чтобы пар занял несколько менее 1/2 объема сосуда b. Наполнив цилиндр сухим воздухом, кладут в него ампулку, закупоривают пробкой и начинают кипятить жидкость в муфте. Воздух, расширяясь, выходит из прибора через отводную трубку, пока наконец весь прибор не примет определенной постоянной темпер. Это узнают, погружая кончик отводной трубки в ванну с водой и замечая, продолжает ли выходить воздух. Когда выделение его прекратилось, вводят под водой конец отводной трубки в измерительный цилиндр и заставляют ампулку упасть вниз, где она и лопается. Вещество, превратившись в Пар, вытесняет соответственный объем воздуха в измерительный цилиндр. Когда выделение воздуха прекратилось (на это требуется доля минуты, так что темпер. и давление можно считать неизменившимся), производят измерение собранного воздуха, проходя обычные поправки на темпер., давление, влажность и пр. Если назовем S — вес вещества, через v — наблюденный объем воздуха при темпер. t и давл. H, ω — упругость водяного Пар при t, то вес воздуха
P = [v(H — ω)0,01293]/[760(1 + 0,003655t)]
Так как вес равного объема Пар = s, то искомая плотность
Δ = S/P = [S×760(1 + 0,003655t)]/[v(H — ω)0,01293]
Вместо того, чтобы брать измерительные цилиндры, иногда соединяют прибор с газовой бюреткой; когда вещество на воздухе разлагается, прибор наполняют азотом; чтобы следы влаги не попали в прибор, бюретка наполняется серной кислотой и пр. Если определение плотности Пар производится при очень высокой температуре, выше 500°—600°, то стеклянный цилиндр заменяется фарфоровым, нагревание производится в Пар, напр., кадмия, цинка или в печах особого устройства и пр.
Способ Гофмана представляет некоторое изменение способа Гей-Люссака, уже вышедшего из употребления. Берется длинная (около 1 м) градуированная трубка с (фиг. 2), наполняется сухой ртутью и опрокидывается над ртутной ванной.
Фиг. 2. Прибор Гофмана.
Трубка окружена стеклянной муфтой b, в которой циркулируют Пар воды или какой-либо другой жидкости, кипящей в сосуде a. В трубку вводят ампулку с навеской исследуемого вещества; она лопается, уровень в трубке понижается, и Пар занимает некоторый объем. Определяют линейкой d высоту столба ртути над уровнем ее в ванне v. Зная объем Пар v, сделав поправку на расширение стекла, температуру t, атмосферное давление H, высоту ртути над уровнем ее в ванне h (производится поправка на изменение длины этого столба от нагревания), давление Пар ртути е при темп. t — найдем, что искомая плотность
Δ = [S(1 + 0,003655t)760]/[v(H — h — e)0,01293],
где S вес вещества. При этих опытах градуированные трубки часто трескаются; поэтому Гофман предложил брать обыкновенные стеклянные, по возможности, цилиндрические трубки, замечать каким-нибудь образом положение мениска ртути при опыте и затем после опыта определять объем, занятый Пар, при помощи ртути обычным путем.
К этой же категории принадлежат способы, основанные на вытеснении паром ртути из сосуда, совершенно наполненного ртутью. По В. Мейеру, берут, напр., широкую трубку с коленчатым отростком внизу и капилляром, емкостью около 35 куб. см; вводят сюда через открытое и направленное кверху колено отростка навеску вещества (около 0,05 г), которую помещают в небольшую скляночку, слегка изогнутую, чтобы она могла пройти в колене отростка; скляночка должна быть наполнена доверху и не заключать воздуха. Прибор после этого взвешивают (с точностью не более 0,1 г), наполняют ртутью, запаивают капилляр и снова взвешивают. Приборчик вешают вертикально на проволоке в стеклянной муфте, подобной вышеописанной a (фиг. 1), и нагревают в Пар кипящей жидкости. Взятое вещество, обратившись в Пар, вытесняет часть ртути приборчика; когда она перестанет вытекать, приборчик осторожно вынимают и взвешивают после охлаждения (тоже с точностью до 0,1 г). Для вычисления плотности находят объем Пар по весу ртути до и после опыта и присоединяют сюда внутренний объем ампулки. Высоту столба ртути над уровнем ее в приборе находят таким образом: тотчас после опыта капилляр вскрывают, приборчик наклоняют, чтобы ртуть поднялась в отростке доверху, и измеряют разность высот. Температура Пар лучше всего определяется термометром, помещенным в муфте, так как при высоких температурах присутствие ртути изменит темп. кипения жидкости в муфте. Делаются обычные поправки на упругость Пар ртути, расширение ее и пр. Вычисление производится по следующей формуле:
Δ = [S(1 + 0,003655t)7988000]/[(P + p — s)[(a + q)(1 + 0,0000303{T — t}) — r(1 + 0,00018{T — t})](1 + 0,00018t)]
где S — вес вещества, Т — температура Пар, t — комнатная температура, Р — давление барометра, привед. к 0°, р — столб ртути в приборе, s — упругость Пар ртути при Т, a — вес ртути до опыта, q — вес ртути в объеме ампулки, r — вес ртути после опыта. Когда требуется определять плотность Пар при высоких темп., выше 400°, напр. в Пар серы (448°), ртуть заменяют сплавом Вуда (15 ч. висмута, 8 ч. свинца, 4 ч. олова, 3 ч. кадмия), плавящимся при 70°. Трубка приборчика тогда заменяется шаром, вместо стеклянной муфты берется железный тигель до 400 куб. см емкости с дырочкой в крышке: в него кладут серу и вешают приборчик. Когда опыт кончен, вынув прибор из тигля, отмечают быстро уровень сплава в шарике и во всем остальном поступают по-предыдущему. Взвешивание прибора с вудовским сплавом стараются производить, пока он еще горяч, так как при застывании сплав, расширяясь, может раздавить прибор. Для расчетов В. Мейер определил уд. вес сплава при разных температурах и др. его свойства. Этот простой приборчик употребляется в несколько измененной форме: к коленчатому отростку припаивают отводную трубочку, через которую вытекает ртуть или сплав Вуда в тарированную склянку, взвешивается в ней непосредственно и т. д.
К другой категории принадлежит классический способ Дюма (фиг 3).
Фиг. 3. прибор Дюма.
Берется стеклянный баллон емкостью от 200 до 500 куб. см, шейка которого вытянута в длинный капилляр. Слегка разогрев, погружают конец капилляра в исследуемое вещество (если оно твердое, его предварительно плавят) и, дав баллону охладиться, насасывают в него таким образом достаточное колич. вещества (5—10 г, смотря по емкости баллона). Баллон помещается в ванне с водой, маслом или др. жидкостью так, что лишь кончик капилляра высовывается наружу. Ванна нагревается на 20°—30° выше темп. кипения исследуемого вещества; последнее, обращаясь в Пар, вытесняет из баллона воздух. Когда выделение Пар прекратилось, кончик капилляра слегка прогревают, чтобы удалить, может быть, сгустившуюся в нем жидкость, и запаивают его; замечают темп. ванны и давление барометра. После охлаждения баллон взвешивают, замечая также температуру и давление барометра, чтобы иметь возможность привести взвешивание к пустоте. Чтобы узнать емкость баллона и количество, может быть, оставшегося в нем воздуха, погружают конец капилляра в ртуть и ломают его. Если в баллоне остался еще воздух, наполняют баллон, погружая его в ртутную ванну так, чтобы уровни ртути в ванне и баллоне были одинаковы; после того баллон взвешивают, затем вновь наполняют и опять взвешивают. Если известен ко всему этому вес пустого баллона и имеется вообще возможность отнести все взвешивания к пустоте, то вычислить искомую плотность нетрудно.
Δ = s/p,
где
p = [v(1 + β T)H0,001293]/[(1 + 0,003665T)760]
Если же в приборе осталось немного воздуха, вес которого q, то
Δ = (s — q)/(p — q)
Здесь v объем баллона при 0° и β коэффициент расширения стекла, s — вес Пар, Т — температура, р — вес воздуха, равного объему Пар при Т и Н. Когда делаются определения плотностей Пар при высоких темп., стеклянный баллон заменяется фарфоровым шаром с капиллярной трубкой; для нагревания его служит железная ванна, в которой кипятится кадмий (около 850°) или цинк (около 1040°); капилляр запаивается при помощи гремучего газа и пр. Способ Дюма, в исполнении очень точный, имеет то неудобство, что требует много вещества. Чтобы избежать этого, Габерманн предложил удалять воздух из баллона выкачиванием, и тогда для определений достаточно бывает брать не более 1 г вещества. При определениях по способу Дюма часто можно избегнуть взвешивания Пар, определяя количество находящегося в баллоне вещества обычным аналитическим путем, напр. титрованием, или переводя в другое соединение с большим весом и пр.
С. Вуколов. Δ.
|
Смотрии так же... |
|