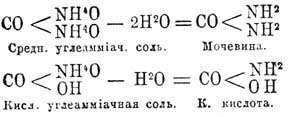Карбаминовая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| К | КЫ | КА | КВ | КГ | КЕ | КЁ | КИ | КЛ | КМ | КН | КО | КР | КС | КТ | КУ | КХ | КШ | КЫ | КЬ | КЭ | КЮ | КЯ |
| КАА |
| КАБ |
| КАВ |
| КАГ |
| КАД |
| КАЕ |
| КАЖ |
| КАЗ |
| КАИ |
| КАЙ |
| КАК |
| КАЛ |
| КАМ |
| КАН |
| КАО |
| КАП |
| КАР |
| КАС |
| КАТ |
| КАУ |
| КАФ |
| КАХ |
| КАЦ |
| КАЧ |
| КАШ |
| КАЩ |
| КАЮ |
| КАЯ |
Карбаминовая кислота (хим.) — представляет первый амид угольной кислоты и имеет состав CO(NH 2)OH. Если производить амиды от аммиачных солей через потерю ими частиц воды, то средняя углеаммиачная соль, теряя 2 частицы воды, даст полный амид угольной кислоты, карбамид, или мочевину (см.), при потере же воды (именно одной ее частицы) кислой углеаммиачной солью получится Карбаминовая кислота кислота. Эти отношения выражаются следующими уравнениями:
Карбаминовая кислота кислота в свободном состоянии неизвестна, но известны ее соли, эфиры (уретаны) и хлорангидрид. Из солей наиболее важна карбаминово-аммиачная соль CO(NH2)NH4 O. Она образуется прямым соединением газообразных углекислоты и аммиака (по уравнению: CO 2 + 2NH3 = CO(NH2)NH4 O) и потому входит в состав продажной углеаммиачной соли (см.), ибо при заводском получении последней с помощью прокаливания смеси нашатыря или серно-аммиачной соли с мелом (СаСО 3) имеются условия как для развития свободных СО 2 и NH 3, так и для их соединения по вышенаписанному уравнению. В чистом виде ее удобно получать, по Базарову, пропуская сухие СО 2 и NH 3 в абсолютный спирт при охлаждении, при чем она осаждается в виде кристаллического порошка. Карбаминово-аммиачная соль кристаллизуется в листочках, издающих запах аммиака и притягивающих влагу из воздуха. Она представляет вещество малопрочное, легко разлагающееся на воздухе на свои компоненты, углекислоту и аммиак (отчего и пахнет аммиаком), а в водных растворах — на холоду постепенно, при нагревании же быстро переходящее в углеаммиачную соль (CO(NH 2)ONH4 + H2O = CO(NH4O)2). Диссоциация карбаминово-аммиачной соли начинается уже значительно ниже 0°; при 15° упругость диссоциации ее равна 26 мм, а при 60° — 770 мм (Naumann). Определение плотности пара, сделанное Науманом при 37°, показывает, что уже при этой температуре карбаминово-аммиачная соль в парах является вполне разложенною на СО 2 и 2NH 3. Из исследований Изамбера следует, что и при более низких температурах, т. е. вообще в парообразном состоянии, карбаминово-аммиачная соль не существует. Кислоты чрезвычайно энергично разлагают ее с выделением углекислоты:
CO(NH2)NH4 + 2HCl = 2NH4Cl + CO2
а щелочи переводят в углекислую соль, выделяя аммиак:
CO(NH2)NH4O + KHO= KHCO3 + 2NH3.
При нагревании в запаянной трубке при 130° — 140° карбаминово-аммиачная соль превращается в мочевину:
СО(NH 2)NH4O = (NH2)CO + H2 O (Базаров).
Из других солей Карбаминовая кислота кислоты известны соли щелочных и щелочноземельных металлов. Все они легко растворимы в воде и весьма непостоянны. Если к слабому водному раствору карбаминово-аммиачной соли прибавить слабого раствора хлористого кальция, то осадка, по причине растворимости карбаминово-кальциевой соли, не образуется, но при стоянии раствор мутится вследствие постепенного превращения Карбаминовая кислота соли в углекислую и осаждения последней. Если пропускать углекислоту в водный раствор аммиака и затем прибавить СаСl 2, то осадка СаСО 3 также не образуется, откуда явствует, что и в этих условиях (в присутствии воды) соединение NH 3 и СО 2 сопровождается образованием сперва не углекислой, а карбаминовокислой соли.
Хлорангидрид Карбаминовая кислота кислоты CO(NH2)Cl получается при действии сухого хлористого водорода на циановокислые соли (W ö hler, 1843), напр.:
AgCNO + 2HCl = AgCl + CO(NH2)Cl
или при действии фосгена (см.) на нашатырь при нагревании (Gattermann u. Schmidt, 1877) по ур.:
COCl2 + NH4Cl = CO(NH2)Cl + 2HCl.
Хлорангидрид представляет жидкость острого запаха, иногда является в форме призматических кристаллов с точкой пл. 50°, кипит при 60° — 62°, разлагается при этом вполне на хлористый водород и циановую кислоту, которые при охлаждении вновь соединяются, но лишь отчасти, так как главная масса циановой кислоты превращается при этом в циамелид (см.). Постепенное превращение в циамелид с потерей HCl происходит и при хранении при обыкновенной температуре. Водой хлорангидрид энергично разлагается на углекислоту и нашатырь:
CO(NH2)Cl + H2O = CO2 + NH4Cl;
со спиртами дает уретаны (см. ниже), или аллофановые эфиры (при избытке хлорангидрида); с аминами — замещенные мочевины:
CO(NH2)Cl + CH3NH2 = CO(NH2)(NHCH З) + HCl;
с ароматическими углеводородами и эфирами фенолов реагирует в присутствии хлористого алюминия, образуя амиды ароматических кислот (Gattermann u. Schmidt). Подобными же свойствами обладают и хлорангидриды замещенных Карбаминовая кислота кислот [Замещенные Карбаминовая кислота кислоты, CO(NHR)OH, подобно самой Карбаминовая кислота кислоте, в свободном состоянии не известны.], получаемые соединением изоциановых эфиров с хлористым водородом (Habich u. Limpncht) или при действии фосгена на нагретые хлористоводородные соли первичных аминов. При соответствующих превращениях эти хлорангидриды образуют соли аминов и замещенные уретаны, двузамещенные мочевины и замещенные амиды ароматических кислот, а при перегонке нацело распадаются на хлористый водород и изоциановые эфиры (см.), обратно сполна соединяющиеся при охлаждении. Хлорангидрид метилкарбаминовой кислоты CO(NH-CH 3)Cl кристалличен, плавится при 90° и кипит при 93° — 94°. Хлорангидрид этилкарбаминовой кислоты CO(NH-C 2H5)Cl жидок и кипит при 92°.
Карбаминовые эфиры, или уретаны, получаются действием аммиака на угольные (Саhours) или хлоругольные эфиры (Dumas):
CO(O-C2 Р 6)2 + NH3 = СО(NН 2)(О-С 2H6) + CO-Cl(O-CH3) + NH3 = CO(NH2)(O-CH З) + HCl;
соединением циановой кислоты со спиртами (Liebig u. W öhler):
CO-NH + C2H5-OH = CO(NH2)(O-C2H5);
взаимодействием спиртов с хлористым цианом (Wurtz):
CNCl + 2C2H5(HO) = CO(NH2)(O-C2H б) + C2H5Cl;
нагреванием мочевины с спиртами (Hofmann):
CO(NH2)2 + C2H5-OH = CO(NH2)(O-C2H6) + NH3;
действием на спирты хлорангидрида Карбаминовая кислота кислоты (Gattermann):
CO(NH2)Cl + C2H5-OH = CO(NH2)(O-C2H5) + HCl.
Уретаны представляют кристаллич. вещества, летучие без разложения, легко растворимые в воде, спирте и эфире. Карбаминово-метиловый эфир, или метиловый уретан, CO(NH 2)(OCH3), плавится при 52°, кипит при 177°; этиловый (обыкновенный) уретан CO(NH 2)(O-C2H6) плавится при 50° — 51° и кипит при 184°. При нагревании с аммиаком или аминами уретаны переходят в соответствующие мочевины; едким кали разлагаются на спирты и цианово-калиевую соль; соединяются с альдегидами при выделении частицы воды; при взаимодействии с хлорангидридами или ангидридами кислот образуют кристаллические продукты замещения аммиачного водорода кислотными радикалами, каков, напр., ацетилуретан CO(NH-C 2H3O)(O-C2H5) (темп. пл. 77° — 78°). При взаимодействии угольных или хлороугольных эфиров с аминами или спиртов с изоциановыми эфирами или хлорангидридами замещенных Карбаминовая кислота кислот получаются замещенные уретаны, из которых принадлежащие к жирному ряду суть жидкости, а к ароматическому — кристаллич. вещества. Метилуретан CO(NH-CH 3)(O-C2H5) кипит при 170°; фенилуретан CO(NH-C 6H5)(O-C2H5) плавится при 52° и кипит при 238°, отчасти разлагаясь на спирт и изоциановый фенил. Особенность замещенных уретанов составляет их способность образовать нитрозопроизводные (Clobbie, 1890) при действии азотистой и нитропроизводные (Franchimont et Clobbie, 1888) при действии безводной азотной кислоты. Таковы, напр., нитрозометилуретан CO(N-CH 3-NO)(O-C2H6) и нитрометилуретан CO(N-CH3-NO2)(O-C2H5). Нитроизопроизводные при действии аммиака разлагаются с выделением азота по уравн.:
CO(N-CH3-NO)(O-C2H5) + NH3= CO(NH2)(O-C2H6) + СН 3 (ОН) + N 2
а нитроизопроизводные при этом распадаются с образованием нитроаминов:
CO(N-СН 3-NO2)(O-C2H5) + NН 3 = CO(NH2)(O-C2H5) + NH(CH3)NO3
нитрометидамин.
П. Рубцов. Δ .
|
Смотрии так же... |
|