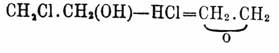Гликоли
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Г | ГА | ГВ | ГД | ГЕ | ГЖ | ГЗ | ГИ | ГЛ | ГМ | ГН | ГО | ГР | ГУ | ГФ | ГХ | ГЫ | ГЬ | ГЭ | ГЮ | ГЯ |
| ГЛА |
| ГЛЕ |
| ГЛИ |
| ГЛО |
| ГЛУ |
| ГЛЫ |
| ГЛЭ |
| ГЛЮ |
| ГЛЯ |
Гликоли (хим.) (Glycol фр. и англ., Glykol нем.). — Гликоли, С 2 Н 6 О 2 = СН 2 (ОН).СН 2 (ОН), получен в 1856 г. Вюрцем как продукт омыления едким кали уксуснокислого эфира
С 2 Н 4 (О 2C2 Н 3)3 + 2КНО = СН 2 (ОН).СН 2 (ОН) + 2КС 2 Н 3 О 2,
полученного, в свою очередь, взаимодействием бромистого этилена с уксуснокислым серебром:
СН 2 Вr.CH 2Br + 2AgC2H3O2 = СH 2 (О 2C2 Н 2).СН 2 (О 2 С 2 Н 3).
Гликоли представляет двухатомный алкоголь (см. Алкоголи), т. е. вещество, по химическим свойствам, промежуточное между одноатомными гомологами винного, обыкновенного спирта — и трехатомными алкоголями, представителем которых является глицерин; это желал Вюрц выразить в названии вещества, так как оно образовано из первого слога французского названия глицерина и последнего слога алкоголя — glyc-ol. Впоследствии слово Гликоли стало нарицательным для всех двухатомных спиртов, в которых гидроксилы находятся при различных атомах углерода [Гликоли, в которых оба гидроксида были бы при одном углеродном атоме, известны только в виде производных (напр. ацеталей — С n Н 2n + 1.CH(OR')2 — R' остаток — радикал — одноатомного спирта), при всех реакциях, когда можно было бы ожидать образования свободных Гликоли этого рода, наблюдается образование или альдегидов, или кетонов, которые можно рассматривать, как ангидридные продукты этих Гликоли (см. Хлоралгидрат).]; для отличия же друг от друга Гликоли называются большей частью по непредельному углеводороду этиленного ряда, из которого мыслимо образование данного Гликоли; так, приведенный выше Гликоли называется этиленгликолем, СН 3.СН (ОН).СН 2 (ОН) — пропиленгликолем, СН 2 (ОН).СН 3.CH2 (ОН) — триметиленгликолем и т. д. Ввиду возможности многочисленных изомеров — положение гидроксилов кроме того обыкновенно указывают греческими буквами, причем α обозначает, что гидроксилы находятся при соседних углеродных атомах, — β и γ, что они разделены одним, двумя углеродными атомами и т. д., напр. триметиленгликоль называется еще ß пропиленгликолем, a СН 3.СН(ОН). СН 2.СН 2.СН 3 (ОН) — γ-амиленгликолем. Кроме того, по характеру спиртовых групп (гидроксилов) между Гликоли различают: первично-первичные, содержащие две группы [СН 2 (ОН)]', вторично-вторичные, содержащие две группы [СH (ОН.)]", третично-третичные, пинаконы, содержащие две группы [C(ОН)]''', и смешанные первично-вторичные, первично-третичные и вторично-третичные (ср. Алкоголи). По большей части Гликоли представляют бесцветные, труднолетучие, но перегоняющиеся без разложения густые жидкости, не обладающие запахом, но довольно ясным сладковатым (иногда горьковатым) вкусом; впрочем, Гликоли вторично-вторичные и третично-третичные, получающиеся из альдегидов и кетонов (см. ниже) — очень часто хорошо кристаллизуются; низшие Гликоли смешиваются во всех отношениях с водой и винным спиртом, высшие же растворяются труднее; в эфире все Гликоли растворимы довольно трудно, причем растворимость возрастает с увеличением частицы Гликоли Как двуатомные алкоголи Гликоли показывают характерные для спиртов реакции, т. е. с кислотами они дают сложные эфиры, с остатками спиртов — простые эфиры; подобно спиртам они относятся и к окислителям, напр. СН 3.СН(ОН).СН 2 (ОН) дает при окислении молочную кислоту — СН 3.СН(ОН).СООН совершенно подобно образованию пропионовой кислоты СН 3.СН 2.СООН из пропилового спирта СН 3.СН 2.СН 2 (ОН) и т. д. (Вюрц). Характерное отличие заключается в том, что в Гликоли в реакции могут участвовать одновременно оба водные остатка, а это вносит особенности, немыслимые для одноатомных спиртов. Так, напр., обыкновенный спирт дает только один хлорангидрид —
C2H5Cl = C2H5 (ОН) + НCl — Н 2 О
— хлористый этил, и один сложный уксусный эфир — С 2 Н 5 О. OC 2H3, a для этиленгликоля известны два хлорангидрида: СН 2 Сl.СН 2 (ОН), называемый хлоргидрином Гликоли (в то же время, одноохлоренный этиловый спирт) и СН 2 Сl.CH 2Cl — хлористый этилен, два уксуснокислых эфира — СН 2 (ОН).СН 2 (О 2 С 2 Н 3) — моно- и диацетин СН 2 (О 2 С 2H3).СН 2 (ОаСаН 3) и т. д. Известны также смешанные галоидангидриды и сложные эфиры Гликоли, где в одной частице присутствуют два различных галоида или одноатомных кислотных остатка, или находятся галоид и кислотный остаток вместе; напр. CH 2J.CH2Cl — хлоройодоэтилен, СН 2 (О 2C2 Н 3).СН 2 (О 2C4 Н 7) — уксусно-масляный эф. Гликоли, СН 2 Cl.СН 2(O2C2H3) — хлороацетин Гликоли и т. д. Точно так же и при окислении напр. этиленгликоля СН 2 (ОН).СН 2 (ОН), смотря по условиями реакции, получаются СН 2 (ОН).СООН — кислота гликолевая, СОН.СООН — кислота глиоксилевая, СОН.СОН — глиоксаль и, наконец, СООН.СООН — кислота щавелевая [СН 2 (ОН).СОН альдегид гликолевый прямой реакцией окисления гликоля пока не получен]; из α пропиленгликоля, кроме молочной кислоты (Вюрц), может быть получена и пировиноградная кисл. — СН 3.СО.СООН (Аристов и Демьянов; окислялся эф. молочной кисл.) и т. д. Впрочем, в некоторых случаях оба гидроксила α Гликоли содержатся не вполне одинаково; так, при действии на Гликоли хлористого или бромистого водорода замещается галоидом только один водный остаток:
СН 2 (ОН).СН 2 (ОН) + НCl = СН 2 (ОН).СН 2 Cl + Н 2 О,
а при действии на Гликоли галоидангидридов кислот один водный остаток замещается галоидом, а на место водородного атома другого становится радикал кислоты:
СН 2 (ОН).СН 2 (ОН) + 2Cl.СО.СН 3 = СН 2.Cl.СН 2 (О.СО.СН 3) + СН 3.СООН + НCl
(Луренцо). Одноатомные спирты, выделяя из двух частиц элементы воды, дают эфиры; для Гликоли аналогичная реакция возможна на счет одной частицы —
С n Н 2n (ОН) 2 — Н 2 О = С n Н 2n О;
образующиеся эфиры называются окисями (см. Окиси органические); они получаются из галоидгидринов Гликоли действием едких щелочей, отнимающих галоидоводород:
но так как галоидгидрины образуются из Гликоли с выделением воды:
СН 2 (ОН).СН 2 (ОН) + НCl = СН 2 Cl.СН 2 (ОН) + Н 2 О,
то реакция образования окисей есть несомненно реакция дегидратации Гликоли (Вюрц). Если же действовать на Гликоли водоотнимающими веществами, каковы: серная кислота, хлористый цинк, то получаются в большинстве случаев не окиси, а изомерные с ними альдегиды или кетоны (Вюрц, Эльтеков); так из этиленгликоля получается альдегид обыкновенный СН 3.СНО (и наряду с ним продукт его уплотнения — кротоновый альдегид, СН 3.СН = СН.СОН (Бауэр), из α пропиленгликоля — пропионовый альдегид — СН 2.СН 2.СНО, ацетон СH 3.СО.СН 3 и продукты их уплотнения и т. д. В некоторых случаях перегруппировка идет далее; так из двутретичных гликолейпинаконов, которые, теряя элементы воды, должны были бы давать прямо окиси — получаются пинаколины — кетоны, содержащие один остаток третичного спирта:
(СН 3)2 С(ОН).(ОН)С(СН 3)2 — Н 2 О = СН 3.СО.С(СН 3)3.
Для некоторых Гликоли однако описаны окиси, полученные прямым действием серной кислоты (напр. — окись γ гексиленгликоля; Липп). Кроме того, мыслимы и известны случаи, когда выделения элементов воды происходит не на счет одной частицы Гликоли, а 2-х или нескольких по общему равенству
ХС n Н 2n (ОН) 2 — (Х — 1)Н 2 О = ХС n Н 2n О(ОН);
сюда относятся так называемые полиэтиленовые алкоголи (Вюрц, Луренцо) — вещества, получающиеся при действии недостаточного количества воды на окись этилена или при нагревании бромистого этилена с этиленгликолем, и относящиеся к классу ангидрогидратных соединений, играющих такую большую роль в неорганической химии, главным образом в химии кремнекислых соединений (Вюрц; ср. Окиси. Для других Гликоли соединения, отвечающие полиэтиленовым, не изучены). Реакции образования α Гликоли следующие: окисление 1% водным раствором марганцово-калиевой соли этиленных углеводородов:
С n Н 2n + Н 2 О + О = С n Н 2n (НО) 2
(Е. Вагнер; — не окисляется и, следовательно, не дает Гликоли триметилен и, вероятно, его гомологи) и превращение галоидных соединений этиленных углеводородов в Гликоли, или реакциями, посредством которых Вюрц получил впервые Гликоли (см. соотв. статью), или же нагреванием их с большим количеством воды в присутствии поташа (Целлер и Гюфнер) или окиси свинца (Эльтеков). В некоторых случаях непредельные спирты, соединяясь с водой, дают Гликоли, напр. аллиловый спирт дает пропиленгликоль (Солонина) изобутенол — изобутиленгликоль (Шешуков). Двувторичные α Гликоли получаются при действии спиртовой щелочи на альдегиды, напр.
3С 3 Н 7.СНО + КНО = C 3H7.COOK + (С 3 Н 7).СН(ОН).(ОН).НС.(С 3 Н 7)
(Фоссек — часть альдегида, как видно из уравнения, окисляется в соответственную кислоту); — при действии спиртовой щелочи на смесь двух альдегидов образуются Гликоли с двумя различными радикалами — напр. из обыкновенного и изомасляного альдегидов получен СН 3.СН(ОН).(OH)HC.(С 3 Н 7) — метил изопропилгликоль (Фоссек и Свобода). Двутретичные α Гликоли, так называемые пинаконы, получаются при восстановлении металлическим натрием, в присутствии воды кетонов, напр.
2(CH3)2 CO (ацетон) + 2Н = (СН 2)2.C(ОН).(ОН)С(СН 3)2 (пинакон)
(Фридель, Фиттиг, Штеллер) [Пинакон может быть получен еще прямым окислением диметилизопропилкарбинола марганцово-калиевой солью (Е. Вагнер): (СН 3)2:С(ОН).СН:(СН 3)2 + O — (СН 3)2:С(ОН).(НО)С:(СH 3)2.]. ß, γ и δ Гликоли получаются или реакцией Вюрца из соответственных галоидных соединений (ß пропиленгликоль образуется уже при кипячении бромистого триметилена с водой — Нидерист) или восстановлением (обыкновенно амальгамой натрия) альдегидо, кетоноспиртов и дикетонов, — так, из альдоля: СН 3.СН(ОН).СH 2.СНО получен СН 2.СН(ОН).СН 2.СН 2 (ОН) — ß бутиленгликоль (Вюрц, Кекуле), из ацетилацетона СН 3.СО.СH 2.СО.СН 3 — СН 3.СН(ОН).СН 2.СН(ОН).СН 3 — ß амилендвувторичный Гликоли (Комб). Двупервичные ß, γ и δ Гликоли получаются из нитрилов двуосновных кислот восстановлением в амины (Ладенбург) и обработкой этих последних азотистой кислотой, напр.
CN.CH2.СН 2.СН 2.CN + 8H = NН 2.СН 2 [СН 2]3.СН 2 Н 2
и NH 2.CH2[CH2]3.CH2.NH2 + 2HNO2 = (OH)CH2[CH2]3.CH2(OH) (δ -амиленгликоль) + 2N 2 + 2Н 2 О
(Густавсон и Демьянов) [Особняком стоят реакции получения α-пропиленгликоля при перегонке глицерата натрия (Белогубек) и триметиленгликоля при брожении глицерина под влиянием бродильных грибков (Фрейнд). Оба случая можно доставить в параллель с реакциями образования бромистого пропилена и триметилена (смотря по условиям) из бромистого аллила, если допустить, что первоначально из глицерина получается аллиловый спирт.]. Что касается методов определения строения Гликоли, то они совершенно не разработаны; некоторое указание на натуру Гликоли могут, по-видимому, дать наблюдения над скоростью превращения в уксуснокислые эфиры (Меншуткин — см. Этерификация). В заключение приведем некоторые физические свойства наиболее изученных Гликоли: этиленгликоль — СН 2 (ОН).СH 2 (ОН) — кипит при 195°, очень густая жидкость, тяжелее воды, застывает при сильном охлаждении и плавится при — 115°, легко и с заметным разогреванием растворяет в себе едкую щелочь; пропиленгликоль — СН 3.СН(ОН).СН 2 (ОН) — кипит при 188° — 189°; триметиленгликоль — СН 2 (ОН).СН 2.СН 2 (ОН) — кипит при 214°, тяжелее воды; пентаметиленгликоль (δ -амиленгликоль) — СН 2 (ОН).[CH 2]3.СН 2 (ОН) — кипит при 260°; все перечисленные Гликоли жидки; — пинакон (тетраметилэтиленгликоль) — (СН 3)2.С(ОН).(НО)С(СН 3)2 — напротив, кристалличен, плавится при 42°, кипит при 171° — 172° и характеризуется своим камфарным запахом; диизопропилэтиленгликоль — (СН 3)2.СН.СН(ОН).(НО)НС.СH(СН 3)2 — плавится при 51,5° и кипит при 222° — 223°. Получение Гликоли, сопровождавшееся синтезом глицерина, при котором Вюрц исходил из йодистого аллила (см. Глицерин), имело в свое время большое теоретическое значение, так как оно способствовало выяснению понятия о многоатомных радикалах (см.), а это понятие, в свою очередь, легло в основании представления об атомности элементов (см. Структура, химич.).
А. И. Горбов. Δ.
|
Смотрии так же... |
|