Окись этилена
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| О | ОА | ОБ | ОВ | ОГ | ОД | ОЕ | ОЖ | ОЗ | ОИ | ОЙ | ОК | ОЛ | ОМ | ОН | ОО | ОП | ОР | ОС | ОТ | ОУ | ОФ | ОХ | ОЦ | ОЧ | ОШ | ОЩ | ОЭ | ОЯ |
| ОКА |
| ОКБ |
| ОКЕ |
| ОКИ |
| ОКК |
| ОКЛ |
| ОКН |
| ОКО |
| ОКР |
| ОКС |
| ОКТ |
| ОКУ |
| ОКЦ |
Окись этилена (oxyde d'éthylène, ä thylenoxyd, хим.) 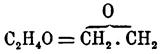 — получена впервые Вюрцем при действии концентрированного раствора едкого кали на хлоргидрин гликоля (см.): СlН 2 С.CН 2 (ОН) — HCl = (CH 2)2 O; удобнее получается она из хлорацетина гликоля [Хлорацетин гликоля получается (Симпсон) при насыщении хлористым водородом моноацетина (HO)H 2 С.CН 2.О 2 С.CН 3 + НСl = СlН 2 С.CН 2.О 2 С.CН 3, а моноацетин образуется при кипячении с обратно поставленным холодильником бромистого этилена (1 часть) с уксуснокалиевой солью (1 часть) и 85% спиртом (2 части; Аткинсон):
— получена впервые Вюрцем при действии концентрированного раствора едкого кали на хлоргидрин гликоля (см.): СlН 2 С.CН 2 (ОН) — HCl = (CH 2)2 O; удобнее получается она из хлорацетина гликоля [Хлорацетин гликоля получается (Симпсон) при насыщении хлористым водородом моноацетина (HO)H 2 С.CН 2.О 2 С.CН 3 + НСl = СlН 2 С.CН 2.О 2 С.CН 3, а моноацетин образуется при кипячении с обратно поставленным холодильником бромистого этилена (1 часть) с уксуснокалиевой солью (1 часть) и 85% спиртом (2 части; Аткинсон):
BrH2 C.СН 2Br | KO2C.CH3 + C2H6 O = (НО)H 2 С.CН 2 (О 2 С.CН 3 + KBr + ВrС 2 Н 5.];
ClH2C.CH2(OOC.CH3) + 2KОН = (СН 2)2 О + KCl + KООС.CH 3 + H2 O (Демоль);
в том и другом случае продукт реакции, газообразный при обыкновенной температуре, пропускают для осушения через трубку с хлористым кальцием и собирают в приемнике, охлажденном смесью льда со снегом. Окись этилена этилена образуется еще при нагревании с Окись этилена серебра йодистого (при 150°) или бромистого этилена (при 250°): С 2H4I2 + Ag2 О = (С 2 Н 4)"О + 2AgI и Окись этилена натрия с бромистым этиленом (при 180°): С 2 Н 4Br2 + Na2O = (C2H4)"O + 2NaBr (? Грин). Окись этилена этилена представляет прозрачную, легкоподвижную жидкость, обладающую приятным, отчасти эфирным запахом, кипит при 14°; удельн. вес (при 0°) = 0,8963 (Вюрц); с водой Окись этилена этилена смешивается во всех отношениях; водный раствор восстановляет аммиачную Окись этилена серебра, но труднее, чем раствор обыкновенного альдегида (с которым Окись этилена этилена изомерна), и под влиянием платиновой черни образует гликолевую кислоту: С 2H4 О + О 2 = СН 2 (ОН).COOH [Может быть, первоначально Окись этилена этилена переходит, присоединяя элементы воды, в гликоль.]. При нагревании (в запаянных трубках) с водой Окись этилена этилена соединяется с нею, давая обратно гликоль, при избытке воды, или полиэтиленовые алкоголи (см.), при недостатке Н 2 О (см.). При действии пятихлористого фосфора Окись этилена этилена дает хлористый этилен: (СН 2 СH 2)"О + РСl 5 = СlН 2 С.CН 2 Сl + РОСl 3. Наиболее характерны для Окись этилена этилена реакции присоединения. Так, она легко соединяется (при действии амальгамы натрия) с водородом, образуя спирт обыкновенный: (С 2 Н 4)"О + Н 2 = C2H5 (OH) (Вюрц). Газообразная Окись этилена этилена с большой энергией соединяется с газообразным хлористым водородом, образуя обратно хлоргидрин гликоля: (С 2 Н 4)"О + НСl = С 2 Н 4 Сl(ОН); реакция идет легко и в водных растворах, даже при действии Окись этилена этилена на водные растворы хлористых металлов, причем образуются гидраты их Окись этилена, например: 2(C 2H4)"O + MgCl3 + 2H2O = 2C2H4Cl(OH) + Mg(OH)2, которые и осаждаются (кроме Mg(OH), могут быть осаждены Окись этилена этилена — Al(OH) 3, Fe(OH)3 и Cu(ОН) 2; Вюрц). Реагируя с синильной кислотой O. этилена образует нитрил этиленмолочной (см. Гидракриловая кислота) кислоты: (С 2 Н 4)"О + HCN = (HO)CH 2.CH2.CN (Вюрц). С аммиаком Окись этилена этилена реагирует очень легко (Вюрц) и если действовать на избыток аммиака (при сильном охлаждении), то затем фракционировкой удается выделить амидоэтиловый (этаноламин) спирт: (С 2 Н 4)"О + NH 3 = H2N.C2H4 (OH), диэтаноламин HO.C 2H4.NH.C2H4.OH = 2(C2H4)"O + NH3 и триэтаноламин (HO.C 2H4)3N = 3(C2H4)"O + NH3 (Кнорр). С концентрированным водным раствором триметиламина окись этилена образует холин:
(CH3)3N + C2H4 O + Н 2 О = НОкись этиленаN(CH 3)3.СН 2.СH 2.ОН (Вюрц).
А. И. Горбов. Δ .
|
Смотрии так же... |
|