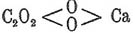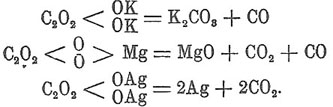Щавелевая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Щ | ЩА | ЩЕ | ЩИ | ЩО | ЩУ |
| ЩАВ |
| ЩАМ |
| ЩАН |
| ЩАП |
Щавелевая кислота — этандикислота (Oxals ä ure, acide oxalique), получена впервые в 1773 г. Совари из кисличной соли (кислая щавелево-калиевая соль); Бергман получил ее окислением сахара азотной кислотой и описал под именем сахарной кислоты; Шееле в 1776 г. установил идентичность обеих кислот. IIриготовление Щавелевая кислота кислоты из сахара было первым случаем получения органического соединения вне организма. В свободном состоянии Щавелевая кислота кислота вообще в природе встречается редко, до сих пор найдена только в грибе Boletus sulfureus; в виде солей находится в растениях и продуктах животного царства. В виде кислого щавелекислого калия — в соке видов oxalis — кислиц. Чаще всего Щавелевая кислота кислота встречается в растениях в виде кристаллических отложений кальциевой соли внутри клеток. Кальциевая соль Щавелевая кислота кислоты составляет часть мочи и выделений некоторых желез. Аммонийная соль Щавелевая кислота кислоты, как продукт разложения мочевой кислоты, находится в гуано. Щавелевая кислота кислота, кроме того, образует некоторые минералы, как вевеллит и тиршит (щавелекислая известь), которые найдены в виде накипи на исландском шпате и мраморе, и гумбольдит (щавелекислая закись железа), найденный в некоторых буроугольных месторождениях. Щавелевая кислота кислота имеет состав, эмпирически выражаемый C 2H2O4, она дает два ряда солей, зефиров и проч., т. е. двуосновна, и заключает две гидроксильных или карбоксильных группы. Строение ее может быть выражено HOOC—COOH. Кристаллизуется с 2-мя частицами воды С 2 Н 2 О 4 ∙2Н 2 О, что соответствует полному гидрату (OH) 3C—C(OH)3 (Штауб и Ватсон Смит). Строение ее подтверждается реакциями получения, из которых теоретически интересны: 1) образование Щавелевая кислота кислоты при действии CO 2 на расплавленный натр при 360° (Дрексель), при чем образуется натриевая соль Щавелевая кислота кислоты:
CO2—CO2 + 2Na = NaOOC—COONa.
2) Щавелевая кислота кислота получается при нагревании до 400° муравьино-калиевой или натриевой соли:
2HСО 2Na = 2H + СО 2 NaСО 2Na.
3) Циан CNCN, как нитрил Щавелевая кислота кислоты, при действии омыляющих веществ дает амид Щавелевая кислота кислоты (оксамид) NН 2COCONH2, а последний легко — Щавелевая кислота кислоту. 4) При осторожном окислении муравьиной кислоты получается Щавелевая кислота кислота. 5) Перхлорэтан C 2Cl6 при продолжительном нагревании с едким кали переходит в Щавелевая кислота кислоту. 6) Окислением сложных органических соединений, для каковой цели употребляют или обработку азотной кислотой или сплавление с едкими щелочами. Последние 2 метода служат для фабричного производства Щавелевая кислота кислоты. Щавелевая кислота кислота кристаллизуется из воды в бесцветных одноклиномерных, сильно двупреломляющих призмах, с двумя молекулами воды (С 2 Н 2 О 4 ∙2Н 2 О), которые теряет при 100° или при стоянии над серной кислотой. Плавится при 101,5°. Безводная кислота при 100° возгоняется, выше 150° С разлагается на воду, углекислоту, окись углерода и муравьиную кислоту, при быстром и сильном нагревании — на воду, окись углерода и углекислоту. Безводная кислота плавится в капиллярных трубках при 189°. Щавелевая кислота кислота растворима в воде, спирте и эфире. 100 частей воды растворяют при 20° 8,8 частей безводной кислоты, 100 частей безводного спирта при 15° — 23,73 частей, 100 частей эфира — 1,27 частей. При нагревании с крепкой серной кислотой Щавелевая кислота кислота распадается на воду, углекислоту и окись углерода. Легко отдающими свой кислород окислителями Щавелевая кислота кислота окисляется нацело, до СО 2:
С 2 Н 2 О 4 + О = 2СО 2 + Н 2 О;
так действует нагревание с азотной кислотой, хлорноватистой, йодной, хромовой, хлорными соединениями золота и платины (выделяются металлы); на холоде, легко — марганцевой кислотой в кислом растворе (реакция применяется в объемном анализе). Щавелевая кислота кислота, как двухосновная, дает с одноатомными металлами два ряда солей, 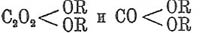 , в зависимости от того, сколько атомов водорода замещаются металлом. Кроме этих двух рядов нормальных солей, она дает легко малопрочные надкислые соли — соединение кислой соли Щавелевая кислота кислоты с частицей кислоты, напр. C 2 О 4HNaC2 О 4 Н 2. Двухатомные металлы дают средние соли, кислые соли их малопостоянны и легко распадаются с выделением Щавелевая кислота кислоты. Составь тех и других выражается:
, в зависимости от того, сколько атомов водорода замещаются металлом. Кроме этих двух рядов нормальных солей, она дает легко малопрочные надкислые соли — соединение кислой соли Щавелевая кислота кислоты с частицей кислоты, напр. C 2 О 4HNaC2 О 4 Н 2. Двухатомные металлы дают средние соли, кислые соли их малопостоянны и легко распадаются с выделением Щавелевая кислота кислоты. Составь тех и других выражается:
средняя кальциевая соль
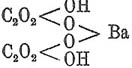
кислая бариевая соль
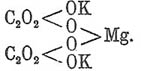
Гораздо постояннее кислых солей легко образующиеся двойные соли с одноатомными металлами, напр.
С окислами М 2 О 3 Щавелевая кислота кислота образует ряд двойных солей K 6Fe2 (С 2 О 4)6∙6H2 О, K 6Cr2 (С 2 О 4)6∙6H2 О, K 2Cr2 (С 2 О 4)4∙10H2 О и т. д. Они представляют соли соответствующих комплексных кислот. Большинство солей Щавелевая кислота кислоты кристаллизуется с водой, которая более или менее легко выделяется. В воде легко растворимы только соли щелочных металлов, большинство солей совсем нерастворимо, в спирте растворима только литиевая соль. При нагревании соли Щавелевая кислота кислоты разлагаются или на углекислую соль и окись углерода, или на окись металла, углекислоту и окись углерода, или на металл и углекислоту в зависимости от постоянства углекислых солей металлов при условиях реакции
Техническое значение из солей имеют: кислая щавелевокислая соль калия с примесью надкислой соли, употребляющаяся для удаления чернильных и ржавчинных пятен; действие основано на образовании двойной растворимой соли окиси железа и калия; K 2 Fe(С 2 О 4)2∙H2 О — двойная соль калия и закиси железа употребляется в фотографии как проявитель, приготовляется смешением растворов железного купороса и средней щавелево-калиевой соли; двойные соли сурьмы калия и натрия употребляются как протравы в красильном деле. Самая характерная соль Щавелевая кислота кислоты есть кальциевая — С 2 О 4 Са, нерастворимая в воде и уксусной кислоте, но растворимая в соляной и азотной; в виде этой соли определяются при анализе кальций и Щавелевая кислота кислота. Щавелевая кислота кислота дает многочисленные производные. Ангидрид Щавелевая кислота кислоты неизвестен. Хлорангидрид СlСОСОСl обыкновенным путем, т. е. действием пятихлористого фосфора на кислоту, не получается, Щавелевая кислота кислота дает при этом воду, углекислоту, окись углерода и хлорокись фосфора. Хлорангидрид получается действием пятихлористого фосфора на средний эфир этилового спирта. Щавелевая кислота кислота, как двухосновная, дает два ряда сложных эфиров со спиртами, из эфиров имеют значение диметилщавелевый СН 3 ОСОСООСН 3, кристаллический, с точкой плавления +54, употребляется для очистки метилового спирта. Соответствующий эфир этилового спирта представляет жидкость. Нитрил Щавелевая кислота кислоты есть циан CNCN (см. это соединение). Амидов два — оба известны. Оксамид NH 2COCONH2 получается при омылении циана и отщеплением воды от аммиачной соли Щавелевая кислота кислоты при нагревании, в виде белого, в воде, спирте и эфире трудно растворимого порошка. Оксаминовая кислота NH 2COCOOH при нагревании кислой щавелево-аммиачной соли растворима в спирте и эфире (подробнее см. Оксамид, Оксаминовая кислота). Имид Щавелевая кислота кислоты СО— NH—СО, оксальимид, получается нагреванием оксаминовой кислоты с пятихлористым фосфором или с хлорокисью фосфора, представляет кристаллически хорошо образованные блестящие призмы, трудно растворимые в холодной воде, с нейтральной реакцией, легко растворим в слабом аммиаке, при кипячении с водой дает оксамид и Щавелевая кислота кислоту, с крепким раствором аммиака дает оксамид.
Заводское производство Щавелевая кислота кислоты основано на окислении различных органических веществ и отбросов азотной кислотой или едкими щелочами. При фабрикации посредством азотной кислоты исходным материалом служат дешевые сорта сахара: глюкоза, полученная из крахмала, или отбросы с сахарных заводов; последние выгоднее употреблять, так как стоимость равного количества сахара в отбросах сахарного производства будет меньше, чем того же количества глюкозы, особенно если употреблять патоку с песочных заводов, которая, кроме того, заключает большое количество калийных солей, вполне утилизируемых при обработке. Ход работы следующий: в глиняных или деревянных, выложенных свинцом сосудах, помещенных в большую водяную баню из кирпича или камня на цементе, с паровым нагревателем, обрабатывают патоку азотной кислотой уд. в. от 1,2 до 1,27 при нагревании до 50° С. На 125 частей продажной патоки или на 100 частей сахара берут 443 части азотной кислоты. При надлежащей температуре и крепости кислоты реакция идет спокойно, с выделением окиси азота, которая по трубам проводится в серные камеры, если есть они на заводе, или, смешиваясь на пути с воздухом и паром, в различного устройства конденсационные приборы. Прибавление небольших количеств серной кислоты к азотной способствует реакции. По окончании выделения газов жидкость спускается в кристаллизационные ящики. Выкристаллизовавшаяся кислота промывается холодной водой, сушится и поступает в продажу. 100 частей сахара дают около 115 ч. кристаллической кислоты. Этот способ, несмотря на всю его простоту и легкость ведения самого процесса, редко применяется, так как очень дорог вследствие употребления окислителем дорогой азотной кислоты, переходящей при реакции в низшие окислы азота, регенерация которых очень затруднительна и дорога; самой лучшей утилизацией выделяющихся окислов являлось бы применение их для камерного процесса, но этому сильно мешает, во-первых, неравномерность выделения газов, обильное в начале реакции и незначительное в конце ее, что для камерного процесса вредно, во-вторых, сравнительно небольшая трата окислов азота при современном камерном процессе благодаря их постоянному улавливанию в башнях. Сплавлением с едкими щелочами получение Щавелевая кислота кислоты хотя и более трудно, но зато значительно дешевле, так как исходным материалом служат отбросы, почти не имеющие цены, главным образом опилки, а едкие щелочи нацело регенерируются, конечно, кроме неизбежных при всяком производстве потерь. Прежде чем перейти к описанию заводского процесса в том виде, как он ведется на фабриках, необходимо подробнее рассмотреть действие едкого калия и натрия на растительную клетчатку различного происхождения и при разных условиях. Образование Щавелевая кислота кислоты при сплавлении органических веществ со щелочами было замечено в 1829 г. Гей-Люссаком, технически способ впервые был разработан Поссоцом (Possoz), и он же ввел его в заводскую практику. Поссоц при своих опытах заметил: 1) что едкие кали и натр относятся неодинаково к реакции, именно, что при сплавлении с едким натром получается гораздо меньше кислоты, чем если сплавлять с едким кали, причем в первом случае окисление органических соединений идет до СО 2. 2) Что смесь обеих щелочей в известной пропорции оказывает наиболее благоприятное влияние на ход реакции с образованием наибольшего количества Щавелевая кислота кислоты. Так, если обозначить через 100 количество Щавелевая кислота кислоты, образующейся при действии чистого едкого кали на крахмал, то при различных отношениях между основаниями получим:
| NaHO+ KHO | получается С 2 Н 2 О 4 |
| — + 100 | 100 |
| 25 + 75 | 110 |
| 33 + 67 | 112,5 |
| 50 + 50 | 100 |
| 67 + 33 | 90 |
| 75 + 25 | 80 |
| 100 + — | незначительное количество |
3) Поссоц заметил, что органические вещества растительного происхождения дают большие выходы Щавелевая кислота кислоты, чем животного. Последующими опытами Торна было установлено: наиболее благоприятная температура реакции 240° С, соотношение между количеством опилок и едкими щелочами, именно 1:2, состав едкой щелочи (40КНО + 60NaHO); кроме того, выяснено, что прибавка к плавящейся массе окислителей, вроде перекиси марганца, улучшает выходы Щавелевая кислота кислоты, что древесные опилки как лиственных, так и хвойных пород дают почти одинаковые количества Щавелевая кислота кислоты, хотя лиственные вообще большие, и что процесс следует вести, по возможности распределяя массу, назначенную для обработки, тонким слоем, чтобы усилить окисление и предохранить самонагревание массы, последствием чего является значительное ухудшение выходов Щавелевая кислота кислоты, как ясно видно из следующей таблицы:
| КНО | NaHO | при работе | |
| в толст. слое | в тонком | ||
| 20 | 80 | 30,04 | 74,76 |
| 30 | 70 | 38,89 | 76,77 |
| 40 | 60 | 43,70 | 80,57 |
| 60 | 40 | 42,64 | 80,08 |
| 80 | 20 | 61,32 | 81.24 |
| 100 | — | 65,51 | 81,23 |
Основываясь на опытах Поссоца и Торна в настоящее время готовят Щавелевая кислота кислоту следующим образом: обливают воздушно-сухие опилки кипящим едким щелоком уд. веса 1,3 до 1,4, употребляя на 1 часть опилок 2 части щелочей (40KHO + 60NaHO), нагревают смесь в железных, плоских, около 2 м диаметром чашах при постоянном механическом помешивании до 240° C, наблюдая, чтобы толщина слоя не превосходила 1,5—2 стм. По мере нагревания сначала испаряется вода, масса становится темно-бурой, появляется своеобразный запах, при 180° окраска массы начинает переходить в желтовато-зеленый цвет, и опилки мало-помалу теряют свою древесную структуру, которая к концу реакции совсем исчезает. Горячий сплав выщелачивают кипящей водой, концентрируют полученный раствор до 38° В., охлаждают, при чем кристаллизуется почти вся Щавелевая кислота кислота в виде щавелево-натриевой соли; кристаллы отделяют центрифугой от маточного рассола, который содержит в себе мало Щавелевая кислота кислоты, углекислые, едкие щелочи и органические вещества. Кристаллы щавелево-натриевой соли перерабатываются на Щавелевая кислота кислоту, а из маточных солей регенерируются заключающиеся в них щелочи, для чего щелочи переводят прибавлением извести — в едкие; полученный раствор, содержащий гуминовые вещества, упаривается досуха, и сухой остаток обжигается при доступе воздуха, при чем получаются углекислые кали и натр, которые идут снова в дело для приготовления едких щелочей. Кристаллы щавелево-натриевой соли растворяются в горячей воде, к раствору при постоянном помешивании и подогревании прибавляют известкового молока до полного осаждения Щавелевая кислота кислоты. Полученный при этой операции едкий натр идет снова в работу, а щавелево-известковая соль подвергается дальнейшей обработке. Для выделения Щавелевая кислота кислоты щавелево-известковую соль при слабом нагревании паром обрабатывают при постоянном помешивании слабой серной кислотой 15—20° В. (1 ч. соли, 2 ч. Н 2SO4 при 66° C), при чем выделяется гипс, а Щавелевая кислота кислота остается в растворе. Осадок гипса отделяют на центрифуге или, еще лучше, на фильтр-прессе и промывают. Раствор содержит, кроме Щавелевая кислота кислоты, серную кислоту и гипс, для выделения которого раствор осторожно паром концентрируют до 15° В. летом, до 10° В. — зимой и охлаждают, гипс после 3-4-часового стояния выкристаллизовывается. Слитый с кристаллов гипса раствор упаривают до 30° В. и кристаллизуют из него Щавелевая кислота кислоту. Кристаллы Щавелевая кислота кислоты для очищения подвергаются повторной кристаллизации; маточный рассол, содержащий Н 2SO4, употребляется снова при обработке щавелево-кальциевой соли. Полученная после перекристаллизации Щавелевая кислота кислота для техники достаточно чиста и содержит около процента серной кислоты и солей калия и натрия. Интересное видоизменение этого распространенного способа патентовано Капитеном и Гертлингом, именно смесь из 20-ти частей опилок, 1,5 частей тяжелых углеводородов (машинного или вазелинового масла) с 40 частями едкого натра в растворе уд. веса 1,35 В. плавят при 200° С., причем реакция идет спокойно, с выделением воды и углеводородов; по прекращении выделения последних масса принимает желтый цвет и оказывается содержащей от 42—43 % Щавелевая кислота кислоты, или, другими словами, из 100 ч. древесной массы получается до 143 ч. Щавелевая кислота кислоты. При этом способе почти не образуется гуминовых веществ, и осаждающаяся при дальнейшей работе щавелево-известковая соль выпадает совсем белой. Кроме того, Щавелевая кислота кислоту, по Ниттлю (Nittl), добывают нагреванием с едким натром отбросных щелоков при сульфитном процессе добычи клетчатки. По Лившицу и Берштейну, получающиеся при обработке дерева на целлюлозу смесью серной и азотной кислот (32 % Н 2SO4, 18—20 % NНО 3 и 50 % H 2 O) отбросные кислоты заключают много Щавелевая кислота кислоты, которую можно нацело получить кристаллизацией, причем из 100 ч. дерева получают от 38—40 % целлюлозы и около 30 % Щавелевая кислота кислоты. Щавелевая кислота кислота в технике имеет довольно значительное применение: она употребляется при крашении бумажных, шерстяных и шелковых тканей как протрава; при приготовлении чернил (для растворения берлинской лазури), розоловой и муравьиной кислот, декстрина, при белении и очищении стеарина.
Н. Тутурин.
|
Смотрии так же... |
|