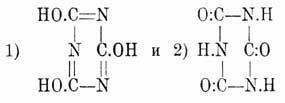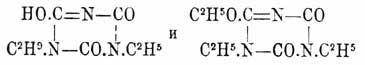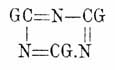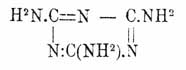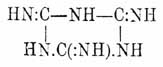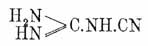Циануровая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Ц | ЦА | ЦВ | ЦЕ | ЦЗ | ЦИ | ЦК | ЦМ | ЦН | ЦО | ЦР | ЦТ | ЦУ | ЦХ | ЦЫ | ЦЭ | ЦЮ | ЦЯ |
| ЦИА |
| ЦИБ |
| ЦИВ |
| ЦИГ |
| ЦИД |
| ЦИЕ |
| ЦИЗ |
| ЦИК |
| ЦИЛ |
| ЦИМ |
| ЦИН |
| ЦИО |
| ЦИП |
| ЦИР |
| ЦИС |
| ЦИТ |
| ЦИУ |
| ЦИФ |
| ЦИХ |
| ЦИЦ |
Циануровая кислота Н 3O3 С 3N3 — трехуплотненный полимер циановой кислоты (см.) впервые была наблюдена еще Шееле между продуктами сухой перегонки мочевой кислоты, затем в 1828 г. ее получил Серюлла при обработке водой трихлортрициана C 3N3Cl3 и с этого времени на протяжении целых трех четвертей столетия она непрерывно привлекает к себе внимание химиков. В изучении ее и ее многочисленных и разнообразных производных принимал участие длинный ряд исследователей, в числе которых стоят такие славные имена, как Либих и Вёлер, Лоран и Жерар, Вюрц, Гофман, Бейльштейн, Готье и др. Интерес изучения обширного материала, представляемого производными Циануровая кислота кислоты, главным образом, возбуждался, с одной стороны, явлениями полимеризации, в результате которых Циануровая кислота кислота и ее производные являются в качестве конечных продуктов, а с другой, — явлениями изомерии, наблюдаемыми во всех почти рядах этих производных, крайне любопытными и весьма отчетливо протекающими превращениями одних изомеров в другие и, наконец, вопросом о строении самой Циануровая кислота кисл. Соответственно двум возможным формулам циановой кислоты (см.) и двум рядам Циануровая кислота эфиров и строение единственной известной Циануровая кислота кислоты может быть представлено двумя таутомерными формулами:
На основании способности Циануровая кислота кислоты образовать хлорангидрид Cl 3C3N3 при действии РС1 5, получаться из этого хлорангидрида при действии воды и при обмыливании так наз. нормальных Циануровая кислота эфиров (см. ниже), а затем превращаться в них при действии, напр., йодюров на циануровосеребряную соль, надо принять в Циануровая кислота кислоте и ее солях строение, выражаемое формулой 1, что и признается большинством химиков. С другой стороны, однако, нельзя не признать формулу 2 более устойчивою в силу того, что, в действительности, в ряду производных Циануровая кислота кислоты, напр. эфиров, изомеры, построенные согласно формуле 1, более или менее легко переходят в изомеры со строением 2, а потому естественнее, казалось бы, предположить, что, раз нам известна только одна форма, то известна именно не менее, а более устойчивая, лишь под влиянием специфических агентов способная переходить в неустойчивую форму с образованием ей отвечающих производных [То же самое соображение может быть высказано и по отношению к строению циановой кисл. (см.).]. Ср. также Триазины. Циануровая кислота кислота обыкновенно получается нагреванием мочевины:
3CO(NH2)2 = C3N3O3H3 + 3NH3 (Wöhler)
или лучше действием на нее хлора при 130 — 140°:
6CO(NH2)2 + 3Cl2 = 2C3N3O3H3 +4NH4Cl + 2HCl + N2 (Wurtz),
или же нагреванием C 3N3Br3 с водою в запаянной трубке при 120 — 140° (Merz u. Weith); кроме того, она и ее соли, из которых свободная Циануровая кислота кислота может быть выделена при содействии кислот, образуются многими другими путями, как то: из циановокалиевой соли, которая при подкислении ее водного раствора уксусной кислотой превращается в кислую циануровокалиевую соль KH 2O3C3N3, из циамелида (см. Циановая кислота — аллотропия), полимеризацией циановой кисл. (см.), при обмыливании нормальных Циануровая кислота эфиров, при действии кислот на ее амидные производные (меламин, аммелин, аммелид), также мелам, псевдосульфоциан и пр., при действии фосгена на аммиак (Bouchardat), при нагревании карбонилдвумочевины, образующейся из мочевины и фосгена при 100°:
CO(NH.СО.ΝΗ 2)2 = C3N3O3H3 + ΝΗ 3
или прямо при нагревании мочевины с раствором фосгена в толуоле при 190 — 230°:
3CO(NH2)2 + 3CОСl 2 = 2C3N3O3H3 + 6НСl (Schiff),
при нагревании ксантогенамида (Debus) и пр. (см. также выше получение ее по Шееле и Серюлла). Циануровая кислота кислота кристаллизуется из водного раствора с двумя молекулами кристаллизационной воды,
H3O3C3N3 + 3Н 2O,
в форме больших бесцветных призм, выветривающихся на воздухе, растворимых в 400 частях холодной воды (безводная кислота требует для растворения, по Шиффу, около 800 ч.) и легче растворимых в горячей воде и в спирте; растворяется без изменения в крепкой серной кислоте; при кипячении с водными кислотами или избытком щелочей распадается на углекислоту и аммиак; при нагревании выше 150° безводная Циануровая кислота кислота превращается в циановую (см.), водная частью разлагается при этом на СО 2 и NH 3. Циануровая кислота кислота трехосновна, но предпочтительно образует кислые одно- и двуметаллические соли. При нейтрализации едким натром на первую его г-мол. выделяется 6,74 сal, на вторую — 4,12 и на третью — всего 1,74 сal. (Lemoult). Щелочные три- и двуметаллические соли Циануровая кислота кислоты в воде растворимы, однометаллические растворимы мало, соли других металлов нерастворимы вовсе. Характерна аметистово-красного цвета аммиачно-медная соль
Cu(NH4)O3C3N3.NH3.H2O,
едва растворимая в водном аммиаке, а также Na 3O3C3N3, кристаллизующаяся в виде тонких иголочек — по своей малой растворимости в горячем и крепком растворе едкого натра. Так назыв. нормальные Циануровая кислота эфиры, строение которых (см. Изоциануровые эфиры) отвечает 1-й формуле Циануровая кислота кислоты, образуются при действии хлористого циана (Hofmann u. Olshausen), a лучше трихлор- или трибромтрициана (Пономарев, Mulder, Hofmann, Clason) на алкоголяты натрия и при действии на холоду йодюров спиртов на Α g3O3C3 Ν 3 (Пономарев). При обмыливании щелочами они распадаются на соответствующие спирты и Циануровая кислота кислоту, при кипячении изомеризуются в соответствующие изоциануровые эфиры (см.), образуют соединения с HgCl 2 и с 6 атомами брома, при действии РСl 5 дают Cl 3C3 Ν 3. Триметиловый эфир (СН 3O)3C3 Ν 3, кристаллизуется в форме игл, темп. пл. 135°, темп. кип. 263°, легко растворим в горячей воде; триэтиловый эфир (C2H5O)3C3 Ν 3, темп. пл. 29°, темп. кип. 275°, в воде трудно растворим, легко в спирте, эфире и пр. Трифениловый эфир (C2H5O)3C3 Ν 3, шелковистые иглы с темп. пл. 224°, получается из фенолата натрия и ClCN или лучше Cl 3C3 Ν 3, очень стоек, не изомеризуется и только при 180° с HCl разлагается на фенол и Циануровая кислота кислоту (Hofmann). Неполным обмыливанием этих эфиров получаются норм. эфирно-Циануровая кислота кислоты (Пономарев, Mulder, Hofmann) НО(CH 3O)2C3 Ν 3 (листочки) и HO(C 2H5O)2C3 Ν 3 (таблички), растворимые в воде, плавящиеся между 160 — 180° и при этом с большим отделением тепла превращающиеся в соответствующие неполные изоциануровые эфиры (Hofmann): НО.С 3O2N3(CH3)2 — одноклиномерные пластинки с темп. пл. 222° и HO.С 3O2N3(C2H5)2 — мелкие иголочки гексагональной системы с темп. пл. 173°; эти эфиры также растворимы в воде и обладают вполне характером кислот, образуя соли, подобно нормальным эфирно-Циануровая кислота кислотам; щелочами они разлагаются на СО 2, NH3 и первичные амины; при действии йодистого этила на AgO.С 3O2N3(C2H5)2 вместе с обыкновенным триэтилизоциануровым эфиром C 3O3N3(C2H5)3 Гофман получил и эфир, отщеплявший с соляною кислотою в запаянной трубке при 100° одну этильную группу в виде C 2H5 Cl и дававший обратно исходный диэтилизоциануровый эфир HO.С 3O2N3(C2H5)2; отсюда строение последнего и отвечающего ему полного эфира, способного легко изомеризоваться в обыкновенный полный изо-эфир, выражается формулами:
Те же самые неполные изоциануровые эфиры получаются также нагреванием одно- и симм. двузамещенных мочевин и т. п. (Wurtz, Habich u. Limpricht, Hofmann, Schiff, Fischer u. Frank). Подобным же путем получен (Fischer и. Frank) и монометильный эфир С 3O3H2N3(CH3) + Н 2 O, обладающий острым запахом, легко растворимый в воде с сильно кислой реакцией, кристаллизующийся из нее в форме тонких листочков, плавящейся (в безводном состоянии) при 297°, легко сублимирующийся и способный перегоняться без разложения. Об изоциануровых эфирах полного замещения см. соотв. статью и Фенилкарбимид. Смешанный циануровоуксусный ангидрид (CH3.CO)3O3C3N2 получен действием хлористого ацетила СН 3.СО.Сl на Ag 3O3C3N3 (Пономарев) — мелкие кристаллы, плавящиеся с разложением при 170° и теплою водою начисто разлагающиеся на Циануровая кислота и уксусную кислоты. Галоидангидриды Циануровая кислота кислоты. Хлористый цианур, твердый хлористый циан, трихлортрициан Cl 3C3N3 (бесцветные, одноклиномерные кристаллы, с острым запахом, с темп. пл. 146° и темп. кип. 190°) и бромистый цианур Br3C3N3 (белый аморфный порошок, плавящийся при 300° и выше улетучивающийся) получаются соответственно полимеризацией хлористого и бромистого циана, ClCN и BrCN, самих по себе или в эфирном растворе в присутствии свободных галоидов или галоидоводородных кислот при хранении или быстрее, при нагревании; полимеризация ClCN сопровождается выделением 18,9 cal. (Lemoult); при кипячении с водой они разлагаются на НСl resp. HBr и Циануровая кислота кислоту, а со щелочами дают МеСl или МеВr и Циануровая кислота соли, почему строение их должно быть представлено формулой
соответственно 1-й формуле Циануровая кислота кислоты. Хлористый цианур получается, кроме того, действием РСl 5 на Циануровая кислота кислоту и норм. Циануровая кислота эфиры (Beilstein, Hofmann) и действием хлора на синильную кислоту при различных условиях (Serullas, Cla ë sson, Fock, Diels и др.), a Br 3C3N3 лучше всего получается нагреванием сухих желтой или красной солей с бромом при 200 — 250° (Merz u. Weith). Йодистый цианур J3C3N3 получается действием HJ на Cl 3C3N3 (Claë sson), представляет темно-бурый порошок; при нагревании выше 300° распадается нацело на йод и парациан (см. Циан), а с водою при 125° дает HJ и Циануровая кислота кислоту. Амидные производные Циануровая кислота кислоты.
Меламин, цианурамид или трициантриамид C3H6N6 = (NH2)3C3N3, полный амид Циануровая кислота кислоты, удобнее всего получается нагреванием хлористого цианура с крепким водным аммиаком: Cl 3C3N3 + 6NH3 =(NH2)3C З N3 + 3NH4Cl (Claë sson, Hofmann); далее он образуется действием NH 3 на норм. Циануровая кислота и тиоциануровые эфиры, напр.,
(CH3S)C3N3 + 3NH3 = (NH2)3C3N3 + 3CH3.SH (Hofmann), полимеризацией цианамида (см. Циановая кислота), при быстром нагревании роданистого аммония до 260° (Claus) и пр. Меламин кристаллизуется в мелких блестящих одноклиномерных призмах, трудно растворимых в спирте, эфире и холодной воде, легко — в горячей, при нагревании сублимируется и уплотняется с выделением аммиака и образованием меллона (см. ниже), представляет сильное однокислотное основание, образующее с кислотами кристаллические соли, напр., C 3C6N3.HCl (Liebig), и при сплавлении с КНО дает, выделяя 3NH 3, циануровокалиевую соль. Последняя реакция, а также два первых из приведенных выше способов образования меламина дают право рассматривать его как норм. амид нормальной Циануровая кислота кислоты (форм. 1), т. е.
Замещенные меламины получаются действием первичных и вторичных аминов, анилина и дифениламина на хлористый цианур (Hofmann, Klason) и при разложении нагреванием с крепкой соляной кислотой дают обратно те же амины и анилины и Циануровая кислота кислоту. Триметилмеламин (NH.CH 3)3C3N3 (т. пл. 130°), триэтилмеламин (NH.C 2H5)3C3N3 (иглы с т. пл. 74°), трифенилмеламин (NH. C6H5)3C3N3 (т. пл. 228°), гексаметилмеламин [N(CH 3)2]3C3N3 (иглы с т. пл. 171°), гексаэтилмеламин [N(C 2H5)2]3C3N3 (жидкость), гексафенилмеламин [N(C 6H5)2]3C3N3 (т. пл. 300°). Образование и распадение последних трех веществ подтверждает гидроксильную формулу (1) Циануровая кислота кислоты (Hofmann). Известны также и смешанные замещенные меламины, напр., (NHC 2H5)(NHCH3)(NH2)C3N3 (т. пл. 176°).
Последнее вещество получается из хлористого цианура последовательным замещением атомов хлора группами NH 2, NHCH3 и NHC 2H5, безразлично, в каком бы порядке это замещение ни производилось, что доказывает симметричность строения Циануровая кислота кислоты (Diels). О производных изомеламина
другой возможной таутомерной формы, отвечающей 2-й формуле Циануровая кислота кислоты, см. соотв. статью. Кипячением со щелочами или кислотами, при постепенном отщеплении аммиака, меламин может быть последовательно переведен в аммелин
C3H5N5O5 = (NH2)2(OH)C3N3 и далее в аммелид или мелануреновую кислоту (NH2)(OH)2C3N3, вещества, промежуточные между меламином и Циануровая кислота кислотой и обладающие одновременно характером кислот и оснований. При таких же условиях они образуются и из мелама, мелема и меллона (Liebig, Klason). Аммелин, легко и чисто получающийся также при нагревании циангуанидина
с циановокалиевой солью, представляет белый микрокристаллический порошок, не растворимый в спирте и эфире и почти не растворимый в воде. Аммелид по виду и свойствам сходен с предыдущим и тоже получается из циангуанидина, но при нагревании с водным раствором углеаммиачной соли; получается также при медленной перегонке мочевины (Liebig u. W ö hler, Laurent et Gerhardt). Для них известны также замещенные производные, получаемые, напр., из замещенных меламинов действием кислот, подобно аммелину и аммелиду, а также эфиры (амидоциануровые эфиры), получаемые неполным действием аммиака на нормальные Циануровая кислота эфиры (Hofmann). Мелам C6H9N11, мелем C6H6N10 и меллон C6H3N9 образуются при нагревании роданистого аммония (см. Родановые соли) и представляют белые аморфные вещества, которые можно рассматривать как продукты уплотнения, по крайней мере, 2 мол. меламина при выделении ими 1, 2 и 3 мол. аммиака.
П. П. Рубцов. Δ .
|
Смотрии так же... |
|