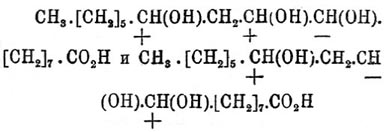Рицинолевая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Р | РА | РБ | РВ | РГ | РД | РЕ | РЖ | РИ | РК | РО | РТ | РУ | РШ | РЫ | РЭ | РЮ | РЯ |
| РИА |
| РИБ |
| РИВ |
| РИГ |
| РИД |
| РИЕ |
| РИЖ |
| РИЗ |
| РИК |
| РИЛ |
| РИМ |
| РИН |
| РИО |
| РИП |
| РИС |
| РИТ |
| РИФ |
| РИХ |
| РИЦ |
| РИЧ |
| РИШ |
Рицинолевая кислота (рицинолеиновая, Ricin ölsä ure; ас. ricinol éique, ricinoleï c; хим.). C 18 Н 34O3 = CH3.[CH2]5.CH(ОН).CH 2.CH:CH.[СН 2]7.СО 2 H — находится в виде глицерида в клещевинном (касторовом) масле (Бюсси и Леканю, Заальмюллер, Петерсен). Получается омылением масла водой при 150° Ц. (Шерер и Кестнер) [Наряду с Рицинолевая кислота кислотой образуется дирицинолевая — С 36 Н 66 О 5 и, при более высокой температуре, тетра- и пента-Рицинолевая кислота кислоты. Ди-Рицинолевая кислота кислота, при нагревании с водной щелочью несколько выше 100° Ц., обратно превращается в Рицинолевая кислота кислоту (её соль).] или едким кали, или соляной кислотой и очищается кристаллизацией кальциевой или бариевой соли (Клаус, Крафт). Кристаллическая масса, плавится при 16—17° (Крафт, Вальден), вращающая в расплавленном состоянии плоскость поляризации вправо, а именно при 20° Ц. для 100 мм [α ]D = +6,67°, а в ацетонном растворе, при С=4,8 до 21, [α ]D = +6,25—7, 5° (Вальден), что обусловлено нахождением в частице асимметрического атома углерода (подчеркнутого выше). Рицинолевая кислота кислота смешивается во всех отношениях со спиртом и эфиром; не поглощает кислорода воздуха. С уксусным ангидридом образует ацетильное производное C 18 Н 33(OC.CH3)О 3 (Диев) наряду с ангидридными продуктами; под влиянием азотистой кислоты превращается в рицинэлаидиновую (см.); с бромом образует маслообразную дибромокислоту С 18 Н 34Br2 О 3. Свинцовая соль — (C 18 Н 33 О 3)2 Pb (высушенная при 100° Ц.) довольно легко растворима в эфире. При сухой перегонке натриевой соли Рицинолевая кислота кислота распадается на энантол (см.) — С 7 Н 14 О и ундециленовую кислоту: С 18 Н 33 NаО 3 = С 6H13.СОН + С 10 Н 19.СО 2 Nа (Штеделер), а при перегонке с избытком едкого натра на вторичный октиловый спирт С 6 Н 13.CH(OH).CH3, себациновую (см.) кислоту: HO 2C.C8H16.CO2H:C18H34O32NaOH + C8H18O + C10H16Na2O4 + Н 2 и метилгексилкетон С 6 Н 13.СО.СН 3:С 18 Н 34O3 + 2NаОН = С 10 Н 16 Nа 2O + C8H16 O + 2Н 2. При окислении азотной кислотой образуются: энантовая кислота С 6 Н 13.СО 2 Н, щавелевая HO 2 С.CO 2 Н и азелаиновая HO 2C.[CH2]7.CO2 H, a при окислении марганцово-калиевой солью — две триоксистеариновые кислоты (Диев, Гацура и Грюсснер) — С 18 Н 33 (ОН) 3O2; одна из них хорошо растворима в эфире, плавится при 110—114° (Диев), 110—111° (Вальден), обладает левым вращением (в уксусной кислоте при С=10—15, [α ]D = —6,25—6,0° (Вальден); другая в эфире почти нерастворима и плавится при 137—140° (Диев); по мнению Вальдена, она должна также обладать оптической деятельностью. При действии йодистого водорода Рицинолевая кислота кислота образует йодостеариновую, которая далее восстановляется в стеариновую (см.) кислоту (Клаус и Газенкампф, см. ниже). Вышеприведенное строение Рицинолевая кислота кислоты выведено на основании следующих наблюдений. Рицинстеаролевая кислота СН 3.[СН 2]5.CH(OH).CH2C:C[CH2]7.СО 2 Н [Рицинстеаролевая кислота может быть получена из дибром-Рицинолевая кислота кислоты при отнятии 2Н спиртовой щелочью при 120°.], присоединяя под влиянием крепкой серной кислоты воду, дает кетоксистеариновую кислоту СН 3.[СН 2]5.СН(ОН)СН 2.СО.(СН 2)7.СО 2 Н, которая при действии гидроксиламина превращается в кетоксимоксистеариновую кислоту СН 3.[CH2]5.CH(OH).[CH2]2.C(NOH).[СН 2]7.СО 2 Н, а эта последняя, под влиянием действия пятихлористого фосфора на ее эфирный раствор, претерпевает Бекмановское превращение (см.), давая кислоты:
СН 3.[CH2]5.CH(OH).[CH2]2.CO.NH.[CH2]7.CO2H (I)
и CH 3.[CH2]5.CH(OH).[CH2]2.NН.СО.[CH 2]7.CO2 Н (II),
которые, впрочем, не удается изолировать, так как в условиях реакции они распадаются дальше и (I) дает — декалактон 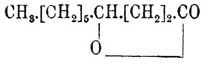 и 8-аминооктанкислоту H 2N.[CH2]7.CO2 H, а (II) — α-гексилтриметиленимин
и 8-аминооктанкислоту H 2N.[CH2]7.CO2 H, а (II) — α-гексилтриметиленимин  и азелаиновую кислоту HO 2C.[CH2]7.CO2 H (Гольдсобель). Кроме этих реакций, кетоксистеариновая кислота CH 3.[CH2]5.CH(OH).CH2.СН 2.СО.[CH 2]7.CO2 H характеризуется еще тем, что при действии аммиака она образует какое-то вещество, окрашивающее в красный цвет сосновую лучинку, смоченную соляной кислотой (пирроловая реакция — см. это слово, и реакция Кнорра на 1,4-дикетоны), а это показывает, что группы CH(OH) и CO находятся в ней в αδ положении; принимая же, что присоединение воды к рицинстеароловой кислоте происходит без перегруппировок и что положение тройной связи в ней отвечает положению двойной связи в Рицинолевая кислота кислоте, мы приходим к единственно возможной формуле строения:
и азелаиновую кислоту HO 2C.[CH2]7.CO2 H (Гольдсобель). Кроме этих реакций, кетоксистеариновая кислота CH 3.[CH2]5.CH(OH).CH2.СН 2.СО.[CH 2]7.CO2 H характеризуется еще тем, что при действии аммиака она образует какое-то вещество, окрашивающее в красный цвет сосновую лучинку, смоченную соляной кислотой (пирроловая реакция — см. это слово, и реакция Кнорра на 1,4-дикетоны), а это показывает, что группы CH(OH) и CO находятся в ней в αδ положении; принимая же, что присоединение воды к рицинстеароловой кислоте происходит без перегруппировок и что положение тройной связи в ней отвечает положению двойной связи в Рицинолевая кислота кислоте, мы приходим к единственно возможной формуле строения:
CH3.[CH2]5.СH(ОН).CH 2.CH:CH.[CH2]7.CO2 Н (Гольдсобель).
Выше указано, что Рицинолевая кислота кислота способна превращаться в рицинэлаиндиновую кислоту (см.), тоже оптически деятельную, но плавящуюся при более высокой температуре и относящуюся поэтому к Рицинолевая кислота кислоте так же, как фумаровая кислота (см.) относится к малеиновой (см.), а потому возможна для неё следующая стереохимическая (см. Стереохимия) формула (Вальден):  (cis -форма), ясно указывающая на оптическую деятельность вещества и позволяющая ожидать образования 2 -х оптически деятельных триоксистеариновых кислот, а именно:
(cis -форма), ясно указывающая на оптическую деятельность вещества и позволяющая ожидать образования 2 -х оптически деятельных триоксистеариновых кислот, а именно:
Нельзя не отметить того обстоятельства, что в настоящее время (1899 г.) весь этот длинный ряд заключений, еще недавно (1894 г.) установленный, является во многих отношениях сомнительным. Исследования Фиттига (1898) показали, что непредельные оксикислоты (ряда С n Н 2n-3 (OH)О 2 и более непредельных) являются в высшей степени неустойчивыми как по отношению к кислотам, так и по отношению к щелочам; Фиттигу удалось установить, например, что кислоты общей формулы R.CH:CH.СН(ОН).СО 2 Н, под влиянием кислот, переходят сначала в оксилактоны формулы — 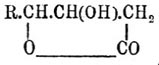 , а затем в γ-кетокислоты R.CO.СН 2.СН 2.СО 2 Н; под влиянием же щелочей исходные кислоты R.CH:CH.CH(OH).CO 2 H превращаются в α-кетокислоты — R.СН 2.СН 2 СО.СО 2 Н. Надо ожидать, что способность к изомеризации не ограничивается только указанными оксикислотами и что она будет наблюдаться и при другом положении гидроксила, а следовательно, и положения гидроксила и двойной связи в Рицинолевая кислота кислоте нельзя считать твердо установленными. Что Рицинолевая кислота кислота изомеризуется как под влиянием щелочей, так и под влиянием кислот, это видно с одной стороны из различия продуктов, образующихся при сухой перегонке натриевой соли Рицинолевая кислота кислоты и ее же перегонки в присутствии избытка едкой щелочи (см. выше), а с другой из того, что подвергнутая действию серной кислоты при обыкновенной температуре она, наряду с поликислотами (см. выше), диоксистеариновой и ее сульфопроизводными (Жюльар, Богаевский), образует еще так называемую изо-Рицинолевая кислота кислоту, которая, по Жюльару, представляет не что иное, как кетостеариновую кислоту (или, может быть, смесь изомерных кетостеариновых кислот). Кроме данного выше способа образования, кетоксистеариновая кислота образуется и из диоксистеариновой кислоты (Гольдсобель); при действии галоидоводородных кислот она замещается гидроксил галоидом, образуя галоидокетостеариновые кислоты, способные при действии цинка (и кислоты) давать стеаролевую кислоту, а под влиянием нагревания с йодистым водородом — стеариновую кислоту (Беренд). Об ализариновом масле см. Пунцовое крашение.
, а затем в γ-кетокислоты R.CO.СН 2.СН 2.СО 2 Н; под влиянием же щелочей исходные кислоты R.CH:CH.CH(OH).CO 2 H превращаются в α-кетокислоты — R.СН 2.СН 2 СО.СО 2 Н. Надо ожидать, что способность к изомеризации не ограничивается только указанными оксикислотами и что она будет наблюдаться и при другом положении гидроксила, а следовательно, и положения гидроксила и двойной связи в Рицинолевая кислота кислоте нельзя считать твердо установленными. Что Рицинолевая кислота кислота изомеризуется как под влиянием щелочей, так и под влиянием кислот, это видно с одной стороны из различия продуктов, образующихся при сухой перегонке натриевой соли Рицинолевая кислота кислоты и ее же перегонки в присутствии избытка едкой щелочи (см. выше), а с другой из того, что подвергнутая действию серной кислоты при обыкновенной температуре она, наряду с поликислотами (см. выше), диоксистеариновой и ее сульфопроизводными (Жюльар, Богаевский), образует еще так называемую изо-Рицинолевая кислота кислоту, которая, по Жюльару, представляет не что иное, как кетостеариновую кислоту (или, может быть, смесь изомерных кетостеариновых кислот). Кроме данного выше способа образования, кетоксистеариновая кислота образуется и из диоксистеариновой кислоты (Гольдсобель); при действии галоидоводородных кислот она замещается гидроксил галоидом, образуя галоидокетостеариновые кислоты, способные при действии цинка (и кислоты) давать стеаролевую кислоту, а под влиянием нагревания с йодистым водородом — стеариновую кислоту (Беренд). Об ализариновом масле см. Пунцовое крашение.
А. И. Горбов. Δ .
|
Смотрии так же... |
|