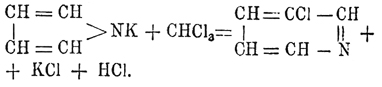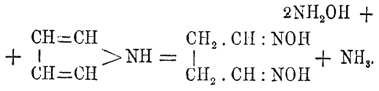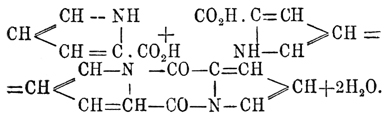Пиррол
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| П | ПЕ | ПА | ПЕ | ПЁ | ПЖ | ПИ | ПЛ | ПН | ПО | ПП | ПР | ПС | ПТ | ПУ | ПФ | ПХ | ПЧ | ПШ | ПЫ | ПЬ | ПЭ | ПЮ | ПЯ |
| ПИА |
| ПИБ |
| ПИВ |
| ПИГ |
| ПИД |
| ПИЕ |
| ПИЖ |
| ПИЗ |
| ПИИ |
| ПИЙ |
| ПИК |
| ПИЛ |
| ПИМ |
| ПИН |
| ПИО |
| ПИП |
| ПИР |
| ПИС |
| ПИТ |
| ПИУ |
| ПИФ |
| ПИХ |
| ПИЦ |
| ПИЧ |
| ПИШ |
| ПИЩ |
| ПИЭ |
| ПИЯ |
Пиррол C4H5 N. — Это соединение впервые открыл в 1834 г. в продуктах перегонки костяного масла Рунге. Название свое Пиррол получил от греческого слова. Πΰρ (огонь) по той причине, что его пары окрашивают сосновую лучинку, смоченную соляной кислотой, в ярко-красный цвет. Кольчатое строение Пиррол представляется формулой 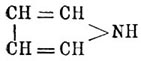 , приближающей его к тиофену (см.) и фурфурану (см.), в которых вместо группы NH стоит в первом атом серы, а во втором атом кислорода. Получается Пиррол главным образом из костяного масла, лучше всего — добытого сухой перегонкой необезжиренных костей. Такое масло содержит нитрилы жирных кислот, от которых оно легко освобождается обмыливанием щелочью, ароматические углеводороды и Пиррол с гомологами, происходящими через замещение атомов водорода метинных групп жирными радикалами. Свободный Пиррол выделяется из порции масла, кипящей при 115—130°, при помощи его калиевой соли (см. ниже). Синтетических реакций, дающих хорошие выходы Пиррол, нет, и они интересны только с теоретической точки зрения, как устанавливающие его строение. Эти реакции следующие: 1) перегонка аммиачных солей сахарной или слизевой кислот, особенно с прибавкою глицерина (тогда достаточно нагревать только до 2000): [CH(OH) 4—(CO2NH4)2 = CH4—NH + NH3 + 4H2 O + 2СO 2; прибавка глицерина, вероятно, может быть объяснена тем, что при 200° он отчасти будет давать акролеин, соединяющийся с образующимся при реакции аммиаком. 2) Соединение ацетилена и аммиака при пропускании их через раскаленные трубки: 2C 2H2 + NH3 = C4H4NH + H2 и 3) воcстановление сукцинимида цинковой пылью: CH 4O2—NH + 2H2 = C4H4NH + 2H2 O. Гомологи Пиррол получаются подобными же способами, заменяя аммиак аминами; но к ним еще нужно прибавить весьма интересный синтез, основанный на необыкновенной способности атомов водорода метииных групп Пиррол кольца к реагированию. Эти водороды с большею легкостью обмениваются на жирные радикалы, чем даже водород NH-группы, а потому при нагревании п-производных (см. ниже) Пиррол они переходят в с-гомологи. Мало того, при пропускании паров Пиррол и какого-либо спирта через раскаленные трубки образуются с-гомологи по равенству: C 4H4—NH + R—OH = C4H3R—NH + H2 О. Пиррол — жидкость, кипящая при 131°, удельного веса 0,9752 при 12,5°, пахнущая отчасти хлороформом. На воздухе он быстро буреет и осмоляется. По своему химическому характеру Пиррол напоминает отчасти анилин, так как растворяется, хотя и медленно, в разведенных кислотах, с другой же стороны, он имеет и кислые свойства, напоминающие фенолы. Следовательно, с этой точки зрения Пиррол резко отличается от вышеупомянутых тиофена и фурфурана, которые индифферентны; однако Пиррол имеет и реакции, приближающие его к этим телам; наиболее характерная из них — это образование индигово-синего вещества не определенного еще строения при растворении Пиррол в крепкой серной кислоте в присутствии изатина или фенантренхинона. При кипячении раствора Пиррол в слабых кислотах он совершенно разрушается, выделяется NH 3 и красное порошкообразное вещество переменного состава, известное под разванием "Pyrrolroth". Эта уже реакция показывает непрочность кольца Пиррол, которое особенно нестойко в кислых средах, где Пиррол сначала всегда подвергается полимеризации и затем уже более глубокому изменению частицы. По этой же причине солей Пиррол неизвестно, получены же только соли три-П., (С 4 Н 4—NH)3, которые при стоянии в растворе полимеризуются еще далее, а при нагревании распадаются на Пиррол, бензопиррол или индол
, приближающей его к тиофену (см.) и фурфурану (см.), в которых вместо группы NH стоит в первом атом серы, а во втором атом кислорода. Получается Пиррол главным образом из костяного масла, лучше всего — добытого сухой перегонкой необезжиренных костей. Такое масло содержит нитрилы жирных кислот, от которых оно легко освобождается обмыливанием щелочью, ароматические углеводороды и Пиррол с гомологами, происходящими через замещение атомов водорода метинных групп жирными радикалами. Свободный Пиррол выделяется из порции масла, кипящей при 115—130°, при помощи его калиевой соли (см. ниже). Синтетических реакций, дающих хорошие выходы Пиррол, нет, и они интересны только с теоретической точки зрения, как устанавливающие его строение. Эти реакции следующие: 1) перегонка аммиачных солей сахарной или слизевой кислот, особенно с прибавкою глицерина (тогда достаточно нагревать только до 2000): [CH(OH) 4—(CO2NH4)2 = CH4—NH + NH3 + 4H2 O + 2СO 2; прибавка глицерина, вероятно, может быть объяснена тем, что при 200° он отчасти будет давать акролеин, соединяющийся с образующимся при реакции аммиаком. 2) Соединение ацетилена и аммиака при пропускании их через раскаленные трубки: 2C 2H2 + NH3 = C4H4NH + H2 и 3) воcстановление сукцинимида цинковой пылью: CH 4O2—NH + 2H2 = C4H4NH + 2H2 O. Гомологи Пиррол получаются подобными же способами, заменяя аммиак аминами; но к ним еще нужно прибавить весьма интересный синтез, основанный на необыкновенной способности атомов водорода метииных групп Пиррол кольца к реагированию. Эти водороды с большею легкостью обмениваются на жирные радикалы, чем даже водород NH-группы, а потому при нагревании п-производных (см. ниже) Пиррол они переходят в с-гомологи. Мало того, при пропускании паров Пиррол и какого-либо спирта через раскаленные трубки образуются с-гомологи по равенству: C 4H4—NH + R—OH = C4H3R—NH + H2 О. Пиррол — жидкость, кипящая при 131°, удельного веса 0,9752 при 12,5°, пахнущая отчасти хлороформом. На воздухе он быстро буреет и осмоляется. По своему химическому характеру Пиррол напоминает отчасти анилин, так как растворяется, хотя и медленно, в разведенных кислотах, с другой же стороны, он имеет и кислые свойства, напоминающие фенолы. Следовательно, с этой точки зрения Пиррол резко отличается от вышеупомянутых тиофена и фурфурана, которые индифферентны; однако Пиррол имеет и реакции, приближающие его к этим телам; наиболее характерная из них — это образование индигово-синего вещества не определенного еще строения при растворении Пиррол в крепкой серной кислоте в присутствии изатина или фенантренхинона. При кипячении раствора Пиррол в слабых кислотах он совершенно разрушается, выделяется NH 3 и красное порошкообразное вещество переменного состава, известное под разванием "Pyrrolroth". Эта уже реакция показывает непрочность кольца Пиррол, которое особенно нестойко в кислых средах, где Пиррол сначала всегда подвергается полимеризации и затем уже более глубокому изменению частицы. По этой же причине солей Пиррол неизвестно, получены же только соли три-П., (С 4 Н 4—NH)3, которые при стоянии в растворе полимеризуются еще далее, а при нагревании распадаются на Пиррол, бензопиррол или индол  и аммиак. Такой распад три-Пиррол характерен тем, что указывает на стремление кольца Пиррол перейти в шестиатомное кольцо. Еще более резко выражается эта тенденция при реакции Пиррол-калия с хлороформом, когда образуется хлорпиридин:
и аммиак. Такой распад три-Пиррол характерен тем, что указывает на стремление кольца Пиррол перейти в шестиатомное кольцо. Еще более резко выражается эта тенденция при реакции Пиррол-калия с хлороформом, когда образуется хлорпиридин:
Оригинально также действие гидроксиламина на П .; здесь опять наблюдается разрыв замкнутого комплекса и образование сукциндиальдоксима:
Ввиду непостоянства кольца Пиррол в кислых жидкостях галоидо- и нитрозамещенные Пиррол обыкновенно готовятся: первые — из галоидозамещенных имидов жирных кислот, а вторые нитрованием Пиррол-кетонов или Пиррол-карбоновых кислот. Исключение представляет тетраиодпиррол, или иодол, C4J4 NH, получающийся непосредственно обработкой Пиррол йодом в присутствии КОН. Это вещество обладает антисептическими свойствами, подобно йодоформу, почему и было предложено употреблять его вместо последнего, так как он совершенно не имеет запаха.
Производные Пиррол обыкновенно разделяют на два класса: п-производные, получающиеся замещением водорода NH-группы, и с-производные — замещением водорода СН-групп. п-Алкил-Пиррол легко получаются (см. выше 3) из замещенных имидов кислот. При нагревании они переходят в с-производные. При действии хлорангидридов жирных кислот получаются п-ацидил-Пиррол; из них наиболее интересен карбонил-Пиррол (С 4 Н 4N)2 =СО, получающийся при действии фосгена СОСl 2 на Пиррол; он представляет твердое тело, плавящееся при 63° и кипящее без разложения при 238°. При нагрвании карбонил-Пиррол претерпевает характерную для всех ацидил-Пиррол перегруппировку атомов: он превращается с одной стороны в дипиррилкетон, или пиррон, (C4H3NH)2 CO (темп. пл. 100°) и в пирроилпиррол С 4 Н 4 N—СО (темп. пл. 63°). Пиррол-карбоновые кислоты получаются аналогично бензолкарбоновым кислотам, только при действии углекислоты на феноляты образуются оксиароматические кислоты, здесь же при действии СО 2 на Пиррол-калий получаются просто карбоновые кислоты. α-Пиррол-карбоновая кислота C4H2 NH—СО 2 Н, в которой карбоксил связан с соседним с азотом атомом углерода, плавится при 192° и при нагрвании с уксусным ангидридом переходит в пиррокол C10H6N2O2 (темп. пл. 268°), получающийся также при сухой перегонке клея, откуда и его название:
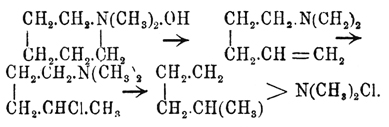
При восстановлении Пиррол и его производные переходят в дигидро-Пиррол, или пирролины, а затем и в тетрагидро-Пиррол, или пирролидины. Вместе с этим переходом резко изменяется и характер Пиррол кольца: из соединений с едва выраженными основными свойствами они переходят в сильные основания, аналогичные вторичным аминам жирного ряда, дающие все реакции, характерные для этих последних. Пирролин C4H6 —NH, растворимая в воде жидкость, кипящая при 91°; имеет запах, напоминающий аммиак, с HNO 2 дает нитрозосоединение C 4H6 N—NO, с йодистым метилом четверичное основание C 4H6NH—JCH3. Пирролидин, или тетраметиленимин, C4H8—NH рассматривается обыкновенно как жирное соединение. Что касается прочности колец пирролидинов, то здесь подмечается довольно любопытный факт: выше было указано, что в Пиррол, имеющем в своем кольце максимум (для пятиатомного ядра) двойных связей, наблюдается стремление переходить в более устойчивый тип шестиатомных колец пиридина или бензола. Когда же кольцо Пиррол вполне гидрогенизовано, след., не имеет двойных связей, то, напротив, оно кажется более устойчивым, и вполне гидрогенизованные шестиатомные кольца пиперидинов имеют наклонность переходить в пирролидины, подобно тому как гексагидробензол переходит в метилпентаметилен (см. Полиметиленовые углеводороды). Точно так же водная окись диметилпиперидиния при перегонке, теряя воду, превращается в буталлилкарбиндиметиламин, который с НСl дает δ-хлорамилдиметиламин, легко изомеризующийся в п, а-производное пирролидина:
(См. также Пирролилен). Кетопирролидины обыкновенно описываются как внутренние ангидриды жирных амидокислот (см. Лактамы), а дикетопирролидины суть имиды (см.) дикарбоновых кислот.
Д. А. Хардин. Δ .
|
Смотрии так же... |
|