Малоновая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| М | МИ | МА | МВ | МГ | МЕ | МЁ | МЗ | МИ | МК | МЛ | МН | МО | МП | МР | МС | МТ | МУ | МХ | МЦ | МШ | МЩ | МЫ | МЬ | МЭ | МЮ | МЯ |
| МАА |
| МАБ |
| МАВ |
| МАГ |
| МАД |
| МАЕ |
| МАЖ |
| МАЗ |
| МАИ |
| МАЙ |
| МАК |
| МАЛ |
| МАМ |
| МАН |
| МАО |
| МАП |
| МАР |
| МАС |
| МАТ |
| МАУ |
| МАФ |
| МАХ |
| МАЦ |
| МАЧ |
| МАШ |
| МАЩ |
| МАЮ |
| МАЯ |
Малоновая кислота (метандикарбоновая кислота) 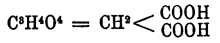 — впервые была получена Дессенье в 1858 г. окислением яблочной кислоты (acidum malicum), откуда и получила свое название. В природе она находится в соке репы. Получают Малоновая кислота кислоту обыкновенно из уксусной кислоты СН 3.СОHО, переводя последнюю в монохлороуксусную кислоту CH 2 Cl.COHO, которая с цианистым калием дает цианоуксусную кислоту CH 2.CN.COHO, и затем обмыливают цианоуксусную кис.:
— впервые была получена Дессенье в 1858 г. окислением яблочной кислоты (acidum malicum), откуда и получила свое название. В природе она находится в соке репы. Получают Малоновая кислота кислоту обыкновенно из уксусной кислоты СН 3.СОHО, переводя последнюю в монохлороуксусную кислоту CH 2 Cl.COHO, которая с цианистым калием дает цианоуксусную кислоту CH 2.CN.COHO, и затем обмыливают цианоуксусную кис.:
CH.2CN.COOH + 2H2O = CH2(COHC)2 + NH3.
Малоновая кислота кислота кристаллизуется в табличках трехклиномерной системы и плавится при 133° -134°. Если ее нагревать в разреженном пространстве несколько ниже температуры плавления, то она сублимируется, не изменяясь. 100 частей воды растворяют при 16°138 частей кислоты. В спирту Малоновая кислота кислота также легко растворима. При нагревании до температуры 140° -150° Малоновая кислота кислота разлагается на углекислый газ и уксусную кислоту:
CH2(COOH)2 = CO2 + CH3.COOH.
Малоновая кислота кислота образует два ряда солей: кислые, напр. COOH.CH 2.COONa, и средние, напр. CH 2.(COONa)2, чем и доказывается ее двухосновность. Соли щелочных металлов хорошо растворяются в воде, соли же других металлов в воде очень мало или вовсе не растворимы. Строение Малоновая кислота кислоты вытекает из способа ее получения.
Особый интерес и огромное значение для синтезов многих органических кислот представляют эфиры Малоновая кислота кислоты. Они способны реагировать с металлическим натрием, при чем выделяется водород, а натрий становится на место водорода метиленовой группы, напр.:
(C2H5.O.CO)2CH2 + Na = (C2H5.O.CO)2CH2 Na + H. Мононатрмалоновые эфиры вступают в двойное разложение с галоидными соединениями, образуя монозамещенные эфиры:
(C2H5.O.CO)2CH2 Na + J.СН 3 = NaJ + (C2H5.O.CO)2CH.CH.CH3.
Монозамещенные M. эфиры, в свою очередь, способны реагировать с металлич. натрием:
(C2H5.O.CO)2 СН. СН 3 + Nа = (C 2H5.O.CO)2 СNа.СН 3 + Н.
При действии галоидангидридов спиртов на полученное натровое производное образуются двузамещенные Малоновая кислота эфиры:
(C2H5.O.CO)2CNa.CH3 + J.C2H5 = (C2H5.O.CO)2(C2H5)С(СН 3).
Обмыливанием эфиров получаются кислоты типа R 2.C(СОНО) 2. По воззрениям Нефа, натрмалоновые эфиры следует рассматривать как непредельные соединения, например 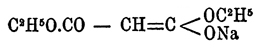 . Тогда механизм образования замещенных Малоновая кислота эфиров нужно представлять как последовательное присоединение галоидангидрида к натрмалоновому эфиру и затем отщепление галоидной соли натрия. Натрмалоновые эфиры получаются обыкновенно действием алкоголята натрия на Малоновая кислота эфиры. Средний этиловый эфир Малоновая кислота кислоты CH 2(COOC2H5)2 — бесцветная жидкость, не растворимая в воде, с темп. кип. 198°. Мононатриевое его производное CHNa(CO.OC 2H5)2 — твердое вещество, кристаллизующееся в блестящих иглах белого цвета. Действием на него йода в эфирном растворе получается эфир этантетракарбоновой кислоты:
. Тогда механизм образования замещенных Малоновая кислота эфиров нужно представлять как последовательное присоединение галоидангидрида к натрмалоновому эфиру и затем отщепление галоидной соли натрия. Натрмалоновые эфиры получаются обыкновенно действием алкоголята натрия на Малоновая кислота эфиры. Средний этиловый эфир Малоновая кислота кислоты CH 2(COOC2H5)2 — бесцветная жидкость, не растворимая в воде, с темп. кип. 198°. Мононатриевое его производное CHNa(CO.OC 2H5)2 — твердое вещество, кристаллизующееся в блестящих иглах белого цвета. Действием на него йода в эфирном растворе получается эфир этантетракарбоновой кислоты:
2(СО 2. C2H5)2 СНNa + J 2 = 2NaJ + (СО 2.C2H5)2 СН.СH(СО 2.C2H5)2.
Динатриевое производное CNa 2(CO2.C2H5)2 — густое сиропообразное, легко изменяющееся вещество, дающее при действии йода эфир этилентетракарбоновой кислоты: (СО 2.C2H5)2 С:C(СО 2.C2H5)2. Если нагревать мононатрмалоновый эфир с эфиром Малоновая кислота кислоты до 120° -150°, то происходит синтез эфира, принадлежащего к ряду бензола. Натрмалоновые эфиры легко разлагаются водой, сам же эфир не растворим в водных щелочах.
Хлорангидрид Малоновая кислота кислоты СН 2(СОСl) 2 получен действием хлористого тионила (SOCl 2) на Малоновая кислота кислоту. Ангидрид Малоновая кислота кислоты неизвестен. Из других производных известны амид CH 2(CONH2)2 и нитрил (см.) CH 2(CN)2. Кроме упомянутого уже способа получения гомологов Малоновая кислота кислоты из натрзамещенных ее эфиров, они могут быть получены также из предельных одноосновных кислот подобно тому, как сама Малоновая кислота кислота получается из уксусной кислоты. При бромировании названных кислот в известных условиях, первый атом брома всегда становится на место водорода к углеродному атому, соседнему с карбоксильной группой. Получающаяся α-бромокислота при действии цианистого калия обменивает бром на циан, и циановая группа при обмыливании дает карбоксильную группу, напр.:
C3H7.CH2.CHBr.COHO + KCN = C3H7.CH2.CHCN.COHO + KBr
и
C3H7.CH2.CHCN.COHO + 2H2O = C3H7.CH2.CH(COHO)2 + NH3.
Гомологи Малоновая кислота кислоты представляют твердые кристаллические вещества, растворимые легко в воде за исключением кислот, имеющих очень большую молекулу. Гомологи Малоновая кислота кислоты разлагаются при нагревании на углекислый газ и соответственную одноосновную кислоту:
C3H7.CH.(COOH)2 = CO2 + C3H7.CH2.COOH.
Как сама Малоновая кислота кислота, так и ее монозамещенные гомологи при действии крепкой азотной кислоты уже при обыкновенной температуре разлагаются с выделением углекислого газа, тогда как двузамещенные гомологи Малоновая кислота кислоты при действии азотной кислоты углекислого газа не выделяют. Простейший представитель гомологов Малоновая кислота кислоты, метилмалоновая кислота СН 3.СH(CООН) 2, носит название изоянтарной кислоты (см. Янтарная кислота).
К. Kрасуский. Δ .
|
Смотрии так же... |
|