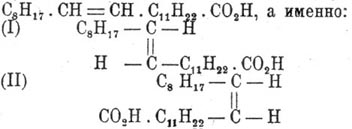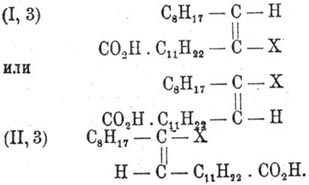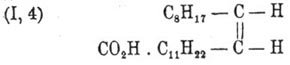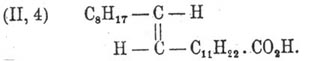Эруковая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Э | ЭА | ЭБ | ЭВ | ЭГ | ЭД | ЭЕ | ЭЖ | ЭЗ | ЭЙ | ЭК | ЭЛ | ЭМ | ЭН | ЭО | ЭП | ЭР | ЭС | ЭТ | ЭУ | ЭФ | ЭХ | ЭЦ | ЭЧ | ЭШ | ЭЭ | ЭЮ | ЭЯ |
| ЭРА |
| ЭРБ |
| ЭРВ |
| ЭРГ |
| ЭРД |
| ЭРЕ |
| ЭРЖ |
| ЭРЗ |
| ЭРИ |
| ЭРК |
| ЭРЛ |
| ЭРМ |
| ЭРН |
| ЭРО |
| ЭРП |
| ЭРР |
| ЭРС |
| ЭРТ |
| ЭРУ |
| ЭРФ |
| ЭРЦ |
| ЭРЧ |
| ЭРШ |
| ЭРЫ |
Эруковая кислота (хим.) — 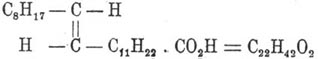 — непредельная кислота из ряда акриловой. Впервые была выделена Дарби в 1849 г. из жирного масла горчичных семян, где она находится в виде глицерида. Кроме того, Эруковая кислота кислота содержится в репном масле из Brassica napus (Вебский) и в масле виноградных зерен (Фитц). Для получения кислоты масло обмыливают окисью свинца и экстрагируют эфиром загустевшую массу. Очищенную эрукново-свинцовую соль разлагают соляной кислотой. Перекристаллизованная из спирта Эруковая кислота кислота образует длинные, тонкие иглы с температурой плавления 33—34° (Отто). Она кипит при 179° в пустоте катодного света и при 264° при 15 мм (Крафт и Вейландт). Удельный вес D 455 = 0,8602, частичное лучепреломление Mα = 105,00 (Эйкман). Теплота горения 3291,7 калорий при постоянном объеме и 3297,2 калории при постоянном давлении; теплота образования 219,8 калорий, считая С = 94 и H 2 = 69 (Штоман и Лангбейн). Как соединение, содержащее одну эталонную связь, Эруковая кислота кислота непосредственно присоединяет два атома брома, образуя дибромбегеновую кислоту С 22 Н 42 Вr 2 О 2; нагревание с йодистым водородом и фосфором до 200—210° переводит ее в соответствующую предельную кислоту — бегеновую C 22H44O2 (Гольдшмидт); хамелеон в щелочном растворе окисляет ее в диоксибегеновую кислоту с температурой плавления 133° (Урванцов); так же действует реактив Каро (Альбицкий). Трудный вопрос о положении двойной связи в частице Эруковая кислота кислоты выяснен работами лаборатории Либермана и сводится к вопросу о строении бегенолевой кислоты, с которой Эруковая кислота кислота связана простыми переходами. Как сказано, Эруковая кислота кислота, присоединяя бром по месту двойной связи, образует дибромбегеновую кислоту. Действуя на эту последнюю спиртовым едким кали сперва на холоде, потом при нагревании до 140—150°, можно последовательно отнять от нее две частицы бромистого водорода и перейти к кислоте пропаргилового ряда — бегенолевой. Работы Гольта и Баруха установили, что в бегенолевой кислоте тройная связь находится между 13-м и 14-м углеродом, считая от карбоксила; на том же, следовательно, месте должна находиться и двойная связь Эруковая кислота кислоты, т. е. формула строения ее будет:
— непредельная кислота из ряда акриловой. Впервые была выделена Дарби в 1849 г. из жирного масла горчичных семян, где она находится в виде глицерида. Кроме того, Эруковая кислота кислота содержится в репном масле из Brassica napus (Вебский) и в масле виноградных зерен (Фитц). Для получения кислоты масло обмыливают окисью свинца и экстрагируют эфиром загустевшую массу. Очищенную эрукново-свинцовую соль разлагают соляной кислотой. Перекристаллизованная из спирта Эруковая кислота кислота образует длинные, тонкие иглы с температурой плавления 33—34° (Отто). Она кипит при 179° в пустоте катодного света и при 264° при 15 мм (Крафт и Вейландт). Удельный вес D 455 = 0,8602, частичное лучепреломление Mα = 105,00 (Эйкман). Теплота горения 3291,7 калорий при постоянном объеме и 3297,2 калории при постоянном давлении; теплота образования 219,8 калорий, считая С = 94 и H 2 = 69 (Штоман и Лангбейн). Как соединение, содержащее одну эталонную связь, Эруковая кислота кислота непосредственно присоединяет два атома брома, образуя дибромбегеновую кислоту С 22 Н 42 Вr 2 О 2; нагревание с йодистым водородом и фосфором до 200—210° переводит ее в соответствующую предельную кислоту — бегеновую C 22H44O2 (Гольдшмидт); хамелеон в щелочном растворе окисляет ее в диоксибегеновую кислоту с температурой плавления 133° (Урванцов); так же действует реактив Каро (Альбицкий). Трудный вопрос о положении двойной связи в частице Эруковая кислота кислоты выяснен работами лаборатории Либермана и сводится к вопросу о строении бегенолевой кислоты, с которой Эруковая кислота кислота связана простыми переходами. Как сказано, Эруковая кислота кислота, присоединяя бром по месту двойной связи, образует дибромбегеновую кислоту. Действуя на эту последнюю спиртовым едким кали сперва на холоде, потом при нагревании до 140—150°, можно последовательно отнять от нее две частицы бромистого водорода и перейти к кислоте пропаргилового ряда — бегенолевой. Работы Гольта и Баруха установили, что в бегенолевой кислоте тройная связь находится между 13-м и 14-м углеродом, считая от карбоксила; на том же, следовательно, месте должна находиться и двойная связь Эруковая кислота кислоты, т. е. формула строения ее будет:
С 8 Н 17 — СН = СН — С 11 Н 22.CO2H.
К такому же заключению приводят и некоторые реакции окисления Эруковая кислота кислоты, сопровождающиеся разрывом ее частицы по месту двойной связи, например при действии азотной кислоты (Филети). Однако при сплавлении Эруковая кислота кислоты с едким кали наблюдается образование уксусной (С 2) и арахиновой (C 20) кислот (Фитц), т. е. двойная связь оказывается как бы между вторым и третьим углеродом. По всей вероятности, это нужно отнести на счет изомеризующего действия самого едкого кали. Одних структурных воззрений оказывается, впрочем, недостаточно для уяснения взаимных переходов между Эруковая кислота кислотой и другой изомерной её кислотой того же акрилового ряда — брассидиновой, имеющей то же самое строение. Переход Эруковая кислота кислоты в брассидиновую с температурой плавления 65—66° совершается при действии азотистой кислоты, а также при продолжительном нагревании в трубке до 200° с кислой сернисто-натриевой солью и сернистой кислотой (М., К. и А. Зайцевы). Согласно воззрениям Иоганна Вислиценуса [Johannes Wislicenus, "Ueber die r ä umliche Anordnung der Atome in organischen Molekulen" ("Abhandl. d. K. S. Gesellsh. d. Wiss.", 2 изд., стр. 47).], такого рода изомерия объясняется возможностью существования двух конфигураций для кислоты С 8H17.СН = СН.С 11 Н 22.СО 2 H, а именно:
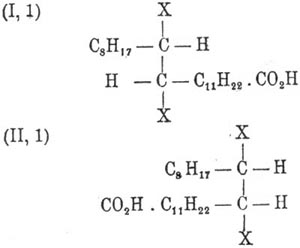
(I) — аксиально-симметрическую конфигурацию Вислиценус приписывает Эруковая кислота кислоте, а (II) — плансимметрическую — брассидиновой. Действительно, как показал Гольт в лаборатории Либермана, присоединяя два атома, например, галоида к Эруковая кислота кислоте, отнимая затем частицу галоидоводорода и замещая оставшийся галоид водородом, можно осуществить взаимный переход обеих кислот друг в друга. Пользуясь стереохимическими представлениями, эти непонятные на первый взгляд переходы объясняются так: присоединение двух атомов галоида (X) к обеим кислотам по месту двойной связи дает продукты
С уничтожением двойной связи углеродные атомы обеих систем получают возможность вращаться и занимать положения, наиболее выгодные при последующей реакции отнятия галоидоводорода. В данном случае это будут:
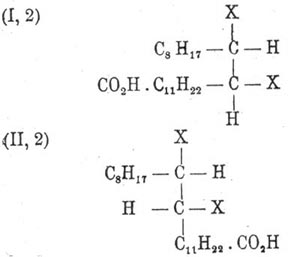
Заметим тут же, что конфигурация (I, 2) допускает более легкое отнятие элементов галоидоводорода, так как в ней оба атома водорода расположены против атомов галоида. Таким свойством как раз отличаются галоидопродукты, происходящие из Эруковая кислота кислоты, чем и подтверждается данная ей Вислиценусом аксиально-симметрическая конфигурация. Отщепление одной частицы галоидоводорода от (I, 2) и (II, 2) снова приводит к образованно непредельных кислот следующих возможных форм:
Наконец, замещая здесь галоид водородом, имеем:
и
Таким образом, после ряда реакций мы приходим от конфигурации (I) к (I, 4) и от (II) к (II, 4), от аксиально-симметрической к плансимметрической и обратно. При этом нет надобности допускать интрамолекулярных перегруппировок. Хотя приложимость схем Вислиценуса не исчерпывается приведенными примерами, однако есть факты, для объяснения которых и стереохимическая гипотеза оказывается недостаточной. Таково, например, образование диоксибегеновой кислоты с температурой плавления 99—100° при действии едкого кали на хлороксибегеновую кислоту, полученную из Эруковая кислота присоединением HClO (Альбицкий). Эта же диоксикислота получается из брассидиновой при окислении ее хамелеоном, а продукт, отвечающий Эруковая кислота кислоте, имеет температуру плавления 133°. Из приведенного примера ясно, что не всегда можно по конфигурации исходного вещества судить о конфигурации полученного продукта. В подобных случаях, по Альбицкому, имеют значение и условия реакции, например кислая или щелочная среда. Кроме пространственного изомера — брассидиновой кислоты, — для Эруковая кислота кислоты известен еще второй структурный изомер изоэруковая кислота, получаемая (вместе с Эруковая кислота) при отнятии йодистого водорода от продукта его присоединения к обыкновенной Эруковая кислота или к брассидиновой кислоте, причем это отнятие совершается в ином направлении, чем присоединение, сопровождаясь, следовательно, перемещением двойной связи. Александров и Н. Зайцев придают ей строение:
СН 3 — (СН 2)17 — СН 2 — СН = СН — COOH.
Как сами изомерные кислоты, так и их производные, в особенности диоксикислоты, характерно отличаются друг от друга по температуре плавления:
| Температуры плавления: | ||
| самих кислот | отвечающих им оксикислот | |
| Эруковая кислота кислота | 33,5° | 133,0° |
| Изоэруковая кислота | 55,0° | 88,0° |
| Брассидиновая кислота | 65,0° | 99,5° |
Из производных Эруковая кислота кислоты известны ее эфиры, соли, галоидопроизводные и ангидрид. Диэруцин (в репном масле) C 47H88O5 — температура плавления 47°, шелковистые кристаллы; триэруцин C 69H128O6 — образуется при нагревании диэруцина с Эруковая кислота кислотой до 300°, кристаллы с температурой плавления 31°; этиловый эфир С 22 Н 41 О 2.С 2 Н 5 — жидкость, кипящая выше 360°; Эруковая кислота ангидрид (C 22H41O)2 O — получается нагреванием Эруковая кислота кислоты с уксусным ангидридом в запаянной трубке в течение 6 часов, температура плавления 47—50°. Соли: Pb(C 22 Н 41O2)2 — плохо растворима в холодном эфире, хорошо — в горячем, употребляется для извлечения Эруковая кислота кислоты из природных продуктов. Кроме того, известны соли Na, Ba и Ag.
Д. Монастырский. Δ.
|
Смотрии так же... |
|