Углеродистый кальций*
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
Смотреть порно онлайн. Сайт с порно: http://porno-mp4.net/analschicy. Порно сайт. |
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| У | УА | УБ | УВ | УГ | УД | УЕ | УЖ | УЗ | УИ | УЙ | УК | УЛ | УМ | УН | УО | УП | УР | УС | УТ | УФ | УХ | УЦ | УЧ | УШ | УЩ | УЭ | УЮ | УЯ |
| УГА |
| УГГ |
| УГЛ |
| УГН |
| УГО |
| УГР |
| УГУ |
| УГЯ |
Углеродистый кальций* [В этой ст. рассматриваются добывание и свойства Углеродистый кальций* кальция, получение из него и технич. свойства ацетилена и применение последнего для освещения.]
кальций-карбид, карбид кальция, СаС 2. — Углеродистый кальций* кальций представляет большой интерес, главным образом, в качестве материала, служащего для получения ацетилена, который в последние годы обратил на себя всеобщее внимание своей необыкновенно высокой осветительной способностью.
Углеродистый кальций* кальций — темно-бурое вещество кристаллического сложения, уд. веса около 2,26, не растворяющееся (без разложения) ни в одном из известных растворителей. С водой Углеродистый кальций* кальций разлагается с образованием газообразного углеводорода ацетилена C 2H2 и гидрата окиси кальция Са(НО) 2, именно: СаС 2 + 2H2O = C2H2 + Ca(HO)2. Реакция идет очень быстро, с выделением большого количества тепла; на 1 кг Углеродистый кальций* кальция должно получаться ацетилена около 348 литров (при 0° и 760 мм давления). Во влажной атмосфере разложение Углеродистый кальций* кальция идет медленно; он покрывается с поверхности коркой Са(НО) 2, которая затрудняет доступ к нему влажности. Сродство Углеродистый кальций* кальция к воде так велико, что его с успехом можно употреблять для выделения последних следов воды, напр., из спирта и других жидкостей или газов. Водные кислоты: соляная, азотная, серная с Углеродистый кальций* кальцием дают ацетилен и соответственные соли кальция, напр.: СаС 2 + 3НСl = CaCl 2 + C2H2. Крепкие кислоты действуют слабее, напр. дымящая азотная кислота даже при кипячении едва разлагает Углеродистый кальций* кальций. Дымящая серная кислота дает меньше C 2H2, так как он ею поглощается. Уксусная кислота безводная не действует на Углеродистый кальций* кальций. При накаливании кислород, сера, галоиды, фосфор разлагают Углеродистый кальций* кальций, соединяясь с кальцием и с углеродом. Подобно кислороду, действуют при нагревании окислители, как хромовая кислота, бертолетова соль и проч. При сплавлении со щелочами происходит энергичная реакция, сопровождающаяся образованием C 2H2. Натрий и магний разлагают Углеродистый кальций* кальций при накаливании.
Способ получения Углеродистый кальций* кальция в больших количествах был выработан главным образом Муассаном в сотрудничестве с Бюлье (Moissan, Bullier); Муассан в 1892 г. показал, что если подвергать накаливанию в вольтовой дуге известь, то на угольных электродах происходит восстановление извести и образование СаС 2. Реакция идет по уравнению: СаО + 3C = СаС 2 + CO. Сотрудник Муассана Бюлье занялся разработкой этого наблюдения и в 1894 г. взял патент на приготовление Углеродистый кальций* кальция. Первые опыты производились с чистой известью, полученной из мрамора, и с углем из молочного сахара. Уголь и известь брались в пропорции, требуемой вышеприведенной реакцией, и тщательно смешивались. Операция велась в так назыв. электрической печке Муассана при токе в 350 амп. и 75 вольт. Накаливание производилось около 15—20 мин.; при этом масса плавилась. Американский инженер Вильсон, занимаясь производством алюминия электрическим путем, задался целью тем же способом получить и металлический кальций, но все попытки его в этом направлении были безуспешны. Он получил темно-серую массу, которую велел выбросить. Но пошел дождь, и масса воспламенилась. По исследовании этого явления Вильсон взял в 1892 г. патент на фабрикацию Углеродистый кальций* кальция. Редко какая-либо отрасль техники имела такой быстрый рост, как производство Углеродистый кальций* кальция, или так наз. карбида. В одной Европе в короткое время было построено заводов на годовую производительность до 120000 тонн; но в последние 2—3 года в развитии карбидного производства произошел резкий поворот благодаря многим случаям взрыва ацетилена. Хотя эти случаи были вызваны недостатками в приборах для получения ацетилена из Углеродистый кальций* кальция, но спрос на Углеродистый кальций* кальций в публике упал, а также и цена на него упала, напр. в Германии до 200 мар. за тонну и даже ниже вместо прежних 600 мар., что едва покрывает издержки производства. Хотя и существуют попытки найти и другие применения для Углеродистый кальций* кальция, напр. для восстановления, для производства цианистых соединений, сажи, графита и т. п., но применения эти имеют мало значения. Производство углекислого кальция вышло бы из кризиса, если бы удалось изобрести безопасную и удобную для употребления переносную лампу. В Германии даже назначена за это премия в 1000 марок. Различия в производстве Углеродистый кальций* кальция на разных заводах заключается главным образом в устройстве электрических печей, на которые постоянно берутся все новые и новые патенты. Из наиболее значительных заводов для выделки кальция можно указать на американский завод у Ниагарского водопада, завод в Берлине, в Швейцарии в Нейгаузене, во Франции в Фроже. Завод у Ниагарского водопада получает электрическую энергию от водопада, работоспособность которого, по некоторым расчетам, равна 1700000 лошадиных сил. Для предварительных опытов был построен завод в Spra y в Сев. Каролине. Устройство печей для получения Углеродистый кальций* кальция видно из прилагаемой фиг. 1.
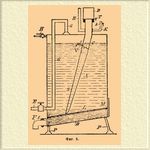
Фиг. 1.
Печь квадратного сечения и сложена из обыкновенного кирпича. Смесь извести и кокса загружается на железную тележку, которая, таким образом, образует под печи. Тележка во время операции движется взад и вперед по рельсам на небольшом расстоянии при помощи стержня f, приходящего сквозь стенку печки; это сделано с той целью, чтобы, с одной стороны, равномернее распределить на ней нагрузку материала при помощи тряски, а с другой, чтобы накаливание массы шло по всей поверхности более или менее одинаково, а не сосредоточивалось бы в каком-либо одном пункте. Длина тележки 1067 мм, ширина 660 мм и глубина 810; она делает 20 колебаний в минуту. В низу печки устроена яма, покрытая решеткой. Когда после операции на эту решетку опоражнивается содержимое тележки, то не вошедшая в реакцию смесь проваливается в яму, из которой по мере накопления и выбирается через особое отверстие. Одним из электродов служит сама тележка; у нее имеется выступ, который захватывается особым пинцетом g, соединенным с электрическим кабелем. На дно тележки кладется слой в 10—20 стм угля или смеси кокса со смолой, чтобы предохранить ее от действия вольтовой дуги. Другой электрод располагается над тележкой; он состоит из стержня о, внутри медного, снаружи железного, с угледержателем. Стержень о висит на цепи, перекинутой через блок, и может опускаться и подниматься по желанию. Угледержатель k l делается составной. Нижняя часть, в которой укреплены угольные стержни, может быть вставлена и вынута горизонтальным движением; это облегчает замену углей. Всех углей 12. Промежутки между ними засыпаны смесью коксовой пыли с газовой смолой. Для защиты от нагревания угольные стержни вверху окружены железным цилиндром. Печь загружается через воронки d, d, в которых для облегчения передвижения массы и регулировки действуют вращающиеся винты. Окись углерода, образующаяся при восстановлении извести, выходит через дымоход q, который нарочно устроен низко, чтобы стержень о по возможности не подвергался нагреванию. Для устранения нагрева о назначен и кожух r, в котором циркулирует холодный воздух, который входит через s и выходить через t. Операция ведется таким образом. Опустив верхний электрод к тележке и получив вольтову дугу, насыпают в тележку смесь кокса с известью. При этом открывают отверстие p и держат его открытым до тех пор, пока через него не покажется пламя; тогда его закрывают. Это делается для вытеснения воздуха из печи, который с накаленной окисью углерода может дать взрыв. Кокс должен содержать по возможности меньше золы, не более 10%; его довольно мелко измельчают, так же как и известь, и просеивают через решета. Известь берется негашеная или гашеная; первая предпочитается; она не должна содержать более 5% примесей; из них наименее желательна магнезия, которой допускают не более 3%. Известь и кокс смешивают по возможности теснее, при чем на 100 ч. извести берут 62—65 ч. кокса. Накаливание производится током в 65—100 вольт при силе в 1700—2000 амп. Операция тянется от 2 ½ до 8 час.; при этом длина угольных стержней в электроде уменьшается в час на 1,2—2,5 мм. В среднем их меняют через 100 час. Во время операции верхний электрод держат на соответственной высоте, руководствуясь показаниями амперметра. Когда операция кончается, ток прекращают, тележке дают охладиться 2—3 часа, затем ее вытаскивают из печи и опрокидывают на решетку. Полученный кусок Углеродистый кальций* кальция имеет вид конуса около 75 стм высоты; в разрезе он меньше поверхности тележки, так как обыкновенно бывает окружен не прореагировавшей смесью; кроме того, на куске Углеродистый кальций* кальция находится небольшой слой Углеродистый кальций* кальция плохого качества. При хорошей фабрикации на 136—180 кг Углеродистый кальций* кальция его не должно получаться более 8—13 кг. Внутренность куска имеет кристаллическое сложение; в особенности кристаллы развиты наверху, и верхняя часть куска часто состоит из более чистого Углеродистый кальций* кальция. Лучший Углеродистый кальций* кальций, дающий до 312 литров ацетилена, получается, когда ток имеет больше вольт; такой Углеродистый кальций* кальций на вид рыжеват. Серый и черный цвет указывают на плохой продукт. По опытам, на приготовление 1 кг Углеродистый кальций* кальция требуется 1,228 кг СаО и 0,837 кг угля (по теория 0,875 СаО и 0,563 С). Замена кокса другим топливом дала худшие результаты. При употреблении древесного угля хотя Углеродистый кальций* кальций получается чище, но зато угля идет больше на 5—10%. Антрацит и битуминозные угли дали худший продукт. Завод Фрож находится между Греноблем и Шамбери; он пользуется водяной силой одного из притоков р. Изер, имея две турбины по 500 сил и одну в 100 сил (по данным 1896 г.). Печи по устройству такие же, как для получения алюминия (фиг. 2).
Фиг. 2.
Печь состоит из четырехугольного графитового тигля A размерами 1,80 х 1,50 х 1,50 м. Наружные стенки его облицованы чугуном. Внутренность его d сообщается с отверстием E для загрузки и с отверстием В для выпуска расплавленной массы в приемник С. Тигель А стоит на колесах и изолирован; к задней стенке А прикреплен отрицательный провод. Положительный электрод состоит из угля D 20 х 20 стм сечения, укрепленного в угледержателе К при помощи 4-х отростков М. К угледержателю К идет положительный провод N; угледержатель К оканчивается винтом P и может подниматься и опускаться при помощи зубчатки S и зубчатки R с рукояткой V. Операция ведется таким образом. Один рабочий засыпает в тигель смесь извести с углем; другой наблюдает за печью, будучи защищен экраном из слюды. Он, смотря по показанию амперметра и вольтметра, поднимает или опускает электрод. О ходе реакции он судит по пламени. Когда операция кончилась, он открывает выпускное отверстие и спускает Углеродистый кальций* кальций в приемник; в это время другой рабочий вновь загружает тигель, так что электрический ток не прерывается. Выпуск Углеродистый кальций* кальция происходит через каждые 40 мин. Угли в электроде быстро расходуются. Во множестве патентов, взятых на печи для производства Углеродистый кальций* кальция, преследуются самые различные цели: в одних стремятся сделать производство непрерывным; в других более экономично утилизировать высокую температуру вольтовой дуги, предварительно прогревая смесь кокса с углем; в третьих предлагают предварительно формовать взятую смесь, так как при плавке происходит распыливание и состав смеси меняется и пр. Во многих патентах затрагивается вопрос о применении других материалов, чем известь и кокс, и пр. Приведем некоторые из новейших патентов. Трост для более полной утилизации электрической энергии предлагает располагать кокс и известь слоями концентрическими или параллельными; таким образом проводящие слои угля будут отделены слоями непроводящей извести. Leede предлагает делать брикеты из смеси извести с газовой смолой, асфальтом и,пр. Масса затем прокаливается в особых ретортах и идет в электрическую печь в виде брикетов или измельченная. На фиг. 3 изображена печь с предварительным подогреванием. W и L — электроды, загрузка происходит через воронку Т; плавка происходит в S. Предварительное прогревание массы происходит в V на счет тепла образующихся при реакции газов. Сименс и Гальске взяли привилегию на печь с трубчатым угольным проводником R (фиг. 4), через который выходит окись углерода.
Фиг. 3. Фиг. 4.
Печь действует непрерывно; расплавленный Углеродистый кальций* кальций стекает в колено A, откуда и выбирается по мере охлаждения. Во всех случаях стоимость Углеродистый кальций* кальция определяется ценой электрической энергии, угля, извести, электродов, рабочих рук и пр. В зависимости от разных условий стоимость 1 тонны Углеродистый кальций* кальция колеблется около 200 мар. Принимают, что 1 электрическая РН. в 24 часа дает около 3—4 кило Углеродистый кальций* кальция. По расчетам Либетанца, пользуясь доменными газами для получения электрической энергии при существующих ценах на кокс, известь и пр., 1000 кило Углеродистый кальций* кальция с упаковкой стоит 160 марок. Для продажи Углеродистый кальций* кальций соответственным образом измельчается и упаковывается. По соглашению германских заводчиков цена устанавливается для 100 кило Углеродистый кальций* кальция в герметической упаковке из листового железа достаточной прочности для перевозки. 1 кило Углеродистый кальций* кальция должен давать не менее 290 литров неочищенного ацетилена (при 0° и 760 мм давления), с точностью до 2%. Продукт, дающий менее 290 литров до 265, может быть не принят покупателем; Углеродистый кальций* кальций не должен быть в кусках более кулака, не должен содержать пыли более 5% (пылью считается все, что отсеивается в сите с отверстиями в 1 кв. мм). В спорных случаях анализ Углеродистый кальций* кальция должен производиться по способам, принятым обществом Deutsche Acetylenverein. Кроме чистого Углеродистый кальций* кальция, в продаже находятся патроны с Углеродистый кальций* кальцием, который мало изменяется при хранении на воздухе без металлической оболочки. Для приготовления такого Углеродистый кальций* кальция взято множество патентов. Напр., Yvonneau берет 16 ч. глюкозы и 4 ч. сала; нагревает при размешивании до 100° и бросает постепенно сюда 80 ч. измельченного Углеродистый кальций* кальция, нагретого до 300°. Масса затем нагревается до 180° и формуется в палочки, которые для защиты от влажности покрываются лаком. Перед тем как бросать их в воду для получения ацетилена, лак немного счищается. Венер и Кандлер обсыпают нагретый измельченный Углеродистый кальций* кальций сахаром, который при этом плавится, и прессуют в нагретых формах, покрытых парафином. Готовые патроны парафинируют. Предлагают пропитывать измельченный Углеродистый кальций* кальций парафином и прессовать и пр.
Степень чистоты продажного Углеродистый кальций* кальция определяется чистотой материалов, пошедших на его производство, а также тем, в каких условиях он хранится; при плохом хранении он может разложиться в значительном количестве от действия влажного воздуха. При анализе Углеродистый кальций* кальция определяют, какое количество газа он выделяет при разложении водой и состав этого газа. Исследования показывают, что состав газов, полученных при разложении Углеродистый кальций* кальция водой, различен не только для разных сортов Углеродистый кальций* кальция, но и для одного и того же сорта он меняется в зависимости от того, как производится разложение. В газе, кроме ацетилена, обыкновенно находится водород, азот, кислород, метан, сероводород, фосфористый водород, кремнистый водород, циан, аммиак и др. Так как куски Углеродистый кальций* кальция вообще неоднородны, то для анализа нужно брать его не менее 50 г. Проба должна предварительно быть измельчена на мельнице, по возможности быстро. Для практики обыкновенно достаточно знать, сколько литров газа получается из 1 кило Углеродистый кальций* кальция. Для этой цели берут большое количество Углеродистый кальций* кальция и разлагают, бросая сразу в воду. Газ собирают в хорошо вымеренный (до ¼ %) газометр, снабженный хорошим термометром и манометром для приведения газа к 0° и 760 мм давления. Для анализа навеску кладут в склянку и разлагают водой, собирая выделяющийся газ для измерения в соответственном газометре над водой, насыщенной предварительно газом, или над раствором поваренной соли. Бамбергер предлагает способ, где газ измеряется по весу и по объему. Навеска Углеродистый кальций* кальция 50—60 г кладется в склянку с двойным горлом емкостью в 400 куб. стм, в одно горло вставляется трубка с хлористым кальцием, а в другое воронка с краном, наполненная 15—20% раствором поваренной соли (200 куб. стм). Весь прибор взвшивают до 0,01 г и, пуская по каплям соляной раствор, медленно разлагают Углеродистый кальций* кальций (реакция идет медленнее, чем с чистой водой), газ высушивается, проходя слой хлористого кальция. Через 3—4 часа, когда вытечет около 100 куб. стм соляного раствора и весь Углеродистый кальций* кальций разложится, быстро спускают остальную жидкость из воронки, взбалтывают немного, нагревают, просасывают через склянку воздух и взвешивают. Таким образом узнают % летучих веществ. Пренебрегая примесями и считая, что 1 кг чистого Углеродистый кальций* кальция по уравн. СаС 2 + Н 2 O = СаО + С 2H2 должен дать 40,625%, или 348,9 литр. ацетилена, Бамбергер составил таблицу, где указано, сколько литров ацетилена дает 1 кг углеродистого кальция в связи с % по весу летучих веществ, выделяемых им при разложении водой. Если нужно собрать газ и определить его объем, соединяют прибор с газометром, который может быть устроен из двух склянок с тубусом у дна, соединенных каучуковой трубкой, как в приборе С. К. Девилля для добывания газов. Что касается собственно определения состава газов, то он совершается по обычным приемам газового анализа. Сероводород, тиосоединения, фосфористый водород окисляются в серную и фосфорную кислоты, проходя, напр., раствор хлорноватисто-натриевой соли или белильной извести; ацетилен поглощается дымящей серной кислотой, кислород — пирогалловой кислотой в присутствии едкого кали, водород и метан определяются эвдиометрическим способом, азот по разности. По анализам Росселя и Ландризета ("Zeitschr. f. ang. Ch.", 1901), газ из хороших сортов Углеродистый кальций* кальция (из 1 кило не менее 290 литр. при 15° и 760 мм) содержит на 100 литров: водорода — до 300 куб. стм, кислорода — 150 куб. стм, азота — 200 куб. стм, аммиака — 500 куб. стм, сероводорода до 250 куб. стм, фосфористого водорода до 53,3 куб. стм; болотный газ ими не найден. Водород, по мнению названных авторов, происходит от следов металлического кальция, образующегося при получении кальция, аммиак — от азотистого магния или кальция; сернистые и фосфористые соединения образованы на счет серы и фосфора, заключающихся в материалах, пошедших на приготовление Углеродистый кальций* кальция. Из указанных примесей для практики главнейшее значение имеют три последних. Опыт показывает, что количество аммиака в газе бывает различно, разлагается ли Углеродистый кальций* кальций водой капля по капле или же он сразу приходит в соприкосновение с большим количеством воды; в последнем случае содержание аммиака может понизиться до 0. То же самое найдено было и по отношению к сероводороду и тиосоединениям; именно клали в небольшую корзиночку 25 г кальция и, опуская его в объемистую склянку (6—7 литров), содержащую воды 5 литров, ниже уровня воды не находили и следов сероводорода при пропускании газа через раствор уксуснокислого свинца; если же корзиночка только касалась воды и смачивались только нижние куски Углеродистый кальций* кальция, то последний сильно разогревался (выше 100°) и раствор свинцовой соли сразу чернел от образовавшегося сернистого свинца. Отыскивая, какое должно быть наименьшее количество воды на 1 часть Углеродистый кальций* кальция, чтобы не было выделения сероводорода, авторы остановились на отношении 1 кило Углеродистый кальций* кальция на 10 литр. воды; при этом температура не превышает 50°. Для практики на 50 кило Углеродистый кальций* кальция можно брать 200 литр. воды, если Углеродистый кальций* кальций бросать в воду не сразу, а порциями, так что вся загрузка должна продолжаться не менее ½ ч. Количество сернистых соединений в газе в таком случае получается незначительное. По анализам Росселя и Ландризета, содержание серы в хороших сортах Углеродистый кальций* кальция доходит до 3,5 г на 1 кило. Если Углеродистый кальций* кальций разлагать, бросая в воду, как указано, то только 2,1% всей серы получается в виде газообразных продуктов; при разложении же водой капля по капле — до 18%. При горении ацетилена сернистые соединения дают не только сернистый газ, но и серный ангидрид, а следовательно, и серную кислоту. Что касается фосфористых соединений, то вообще они представляют менее значения, чем соединения серы. В хороших сортах Углеродистый кальций* кальция авторами найдено все содержание фосфора не более 0,525 г на 1 кило. В газе содержатся только часть этого количества, сообщая ацетилену неприятный запах. Для удаления фосфористого водорода обыкновенно пропускают ацетилен через раствор белильной извести, которая окисляет фосфористый водород вместе с сернистыми соединениями. Россель и Ландризет рекомендуют для той же цели бросать белильную известь в самый прибор для выделения ацетилена в количестве 5—20 г на 1 кило Углеродистый кальций* кальция. Окончательная очистка ацетилена от соединений серы и фосфора для горения достигается промыванием его водой, в которой разболтана известь; на 50 кило Углеродистый кальций* кальция берут 100 литр. воды, в которую вливают 1—2 кило известкового молока.
Главный продукт, получаемый из Углеродистый кальций* кальция, есть, как уже сказано выше, углеводород ацетилен C 2H2. Совершенно чистый ацетилен бесцветен и имеет приятный эфирный запах. Тот противный запах, который бывает у обыкновенного ацетилена, зависит от присутствия в нем различных примесей, главным образом фосфористого водорода; 1 литр C 2H2 весит при 0° и 760 мм давления 1,169 г. Теплота образования его из элементов (при угле аморфном) — 51,5 б. кал., а теплота горения 318 б. кал. (при воде жидкой). Будучи образован с таким большим поглощением тепла, C 2H2 способен разлагаться со взрывом под влиянием взрыва капсюля гремучей ртути и друг. детонаторов. При обыкновенных условиях вода, сернистый углерод растворяют ок. 1 об. C 2H2; вода, насыщенная поваренной солью, растворяет около 1/20 своего объема; керосин растворяет 1,5 об.; скипидар — 2; хлороформ, бензин — 4 об.; абсолютный спирт, уксусная кислота — 6 об., ацетон — около 25 об. С водой ацетилен дает гидрат состава C 2H2x6H2 O, который очень непрочен: при 0° упругость диссоциации его равна 3,75 атм. Смесь C 2H2 с воздухом при зажигании взрывает; maximum взрыва получается, когда на 1 об. C 2H2 приходятся 14 об. воздуха; при 20 об. воздуха смесь перестает быть взрывчатой. Характерная реакция на ацетилен — действие аммиачного раствора полухлористой меди; при этом образуется бурое вещество, ацетиленистая медь C 2H2∙Cu2 O; она взрывает от нагревания до 95—120° и от удара; при этом получается вода, медь, уголь, углекислота и следы окиси углерода. Подобное же соединение получается с аммиачным раствором азотнокислого серебра. Ацетилен, не содержащий аммиака, не действует на медь, латунь и на бронзу с образованием ацетиленистой меди. При 15° ацетилен обращается в жидкость при давлении около 38 атм., по Виляру. Критическая темп. его 37°, а критическое давление 68 атм. При 0° давление паров жидкого ацетилена = 26 атм. Около —81° давление паров = 1 атм., при —85° он затвердевает и плавится около —81°. Жидкий ацетилен представляет подвижную прозрачную жидкость уд. веса меньше воды (при 0° — 0,451 и при 35,8° — 0,364); при выпускании на воздух она превращается в снегообразную массу, которая может гореть. Для дыхания ацетилен менее вреден, чем обыкновенный светильный газ (который может заключать иногда до 10% окиси углерода), не говоря уже о генераторном газе. По опытам Grehant, в воздухе, содержащем 40% ацетилена, животное умирает только через 50 мин., а при содержании 79% — через 27 мин. Если к тому же принять во внимание, что ацетилен вследствие примесей имеет резкий неприятный запах, так что утечка его в жилых помещениях может быть очень скоро замечена, то опасность отравления ацетиленом понижается до mmimum'a.
С точки зрения осветительной техники, важно было изучить все условия горения ацетилена, особенно же имея в виду способность его при известных обстоятельствах разлагаться со взрывом. Ацетилен горит белым ослепительным пламенем, что обусловливается отчасти большим содержанием в газе углерода (92,3%), выделяющиеся частички которого сильно накалены и излучают много света. Насколько ацетилен дает при горении больше света по сравнению с другими горючими газами, видно из следующего сопоставления, в котором сила света дана в карселях, считая на 1 куб. м различных газов в 1 час. Данные получены при расходе газа 141,6 литра: метан 3,5; парижский светильный газ 9,6, лондонский светильный газ 11,5 (при употреблении горелки Ауэра 48,6); этан 25; пропан 40; этилен 49; бутилен 86; ацетилен 168. На одну свечу в час требуется около 0,6 литра ацетилена; в общем ацетилен в 15—18 раз дает больше света, чем светильный газ в обыкновенной горелке и в 3—4 раза больше при горелке Ауэра; при этом температура пламени у ацетилена меньше. Если вычислить, сколько тепла выделяется при горении вышеприведенных газов на одно и то же количество света, то найдем, что для ацетилена оно меньше всех: ацетилен дает тепла немного больше обыкновенной электрической лампочки. С другой стороны, количество воздуха, необходимого для горения ацетилена по уравн.: C 2H2 + 3О 2 = 2CO2 + H2 O, меньше, чем для светильного газа, на одно и то же количество света; напр. для горения светильного газа при силе света в 1 свечу в час требуется по меньшей мере 16 литров воздуха, тогда как для ацетилена (принимая расход его на 1 свечу в час 0,6—0,7 л) нужно около 7 литров воздуха. Это обстоятельство в связи с тем, что ацетилен дает меньше тепла на одно и то же количество света, дает ему большое преимущество перед светильным газом при освещении жилых помещений, публичных зал и пр., облегчая заботу о вентиляции. Имея уд. вес почти в два раза более светильного газа, ацетилен требует большого давления для передвижения по трубам с определенной скоростью; кроме того, для полноты горения его требуются особые условия, иначе будет образовываться копоть; чтобы достигнуть этого, горелки для ацетилена имеют тонкие отверстия и газ выходит из них под большим давлением (40—100 мм водяного столба), отчего получается более полное перемешивание его с воздухом. В некоторых горелках две струи газа встречаются под углом, что облегчает приток воздуха, и пр. При слишком тонких отверстиях горелки часто засоряются, и их приходится чистить. По сравнению различных систем освещения в результате оказывается, что ацетиленовое освещение по дешевизне уступает только вольтовой дуге и ауэровской горелке; напр. в Германии при цене на карбид 33 пфен. за кило 1 свеча будет стоить 0,077 пф. при употреблении ацетилена, 0,160 пфен. для каменноугольного газа с обыкновенной горелкой; 0,039 пфен. то же с ауэровской горелкой; 0,218 — для электрич. лампы накаливания, 0,306 — для нефтяного газа, 0,84 — для керосина, 0,115 — для спирта, 0,040 — для вольтовой дуги.
Главным препятствием для распространения ацетиленового освещения является способность ацетилена взрывать в известных условиях. Подобно др. горючим газам, он дает с воздухом смеси, взрывающие при воспламенении. Нижний предел для таких смесей 2,8% газа и высший 65%. Темпер., при которой воспламеняются ацетиленовые смеси, значительно ниже, чем для смеси светильного газа с воздухом (480° вместо 600°). Скорость, с которой передается воспламенение, сначала, при содержании до 3% газа, ничтожна (10 стм в 1 сек.), при 5% — 15% доходит до 4—8 м в секунду. Затем она уменьшается при 25% до 40 стм и при 60% падает до 5 стм. Если воспламенение передается из одного места в другое по трубам, то диаметр труб играет большую роль: при диам. в 0,5 мм воспламенение совсем не передается; при диам. в 0,8 мм воспламенение передается при составе 7,7% — 10%; 2 мм — 5% — 15%; 6 мм — 4% — 40 % и т. д. Температура при взрыве зависит от % состава смеси благодаря затрате тепла на нагревание газов, не участвующих в горении, напр. при содержании 7,74% ацетилена она около 2420°, при 12,2% — 2260°. При горении в чистом кислороде она должна получиться около 4000°, почти на 1000° выше той, которую имеет гремучий газ. Это обстоятельство (зависящее отчасти и от того, что ацетилен образован с поглощением тепла) делает его очень ценным для получения высоких температур. Не только смеси ацетилена с воздухом, но и чистый ацетилен сам по себе способен взрывать. Опыт показывает, что если в ацетиленовом газе, сжатом при давлении более 2-х атмосфер, накаливать электрическим током проволоку, пропустить электрическую искру или взорвать капсюль гремучей ртути, то ацетилен разлагается во всей массе с большой скоростью — взрывает; разложение идет по уравнению: C 2H2 = C2 + H2. Углерод получается в виде очень рыхлой сажи со следами графита; водород, нагретый выделившимся при разложении теплом (на 1 молекулу 51,4 кил.), производит давления, значительно превышающие те, которые имел ацетилен перед взрывом. Разложение ацетилена в закрытом пространстве было изучено главным образом Бертело и Вьелем, которые применяли для этой цели так наз. манометрическую бомбу с крешерным прибором. Результат их опытов следующий. Скорость разложения тем больше, чем выше первоначальное давление взятого ацетилена; в том же направлении изменяется и максимальное давление газа в момент взрыва. Напр., при начальном давлении ацетилена 2,23 кило (на 1 кв. стм) давление при взрыве доходит до 10,7 к.; 3,5 — 19,0; 5,98 — 43,43; 11,2 — 92,7; 21,1 — 213,7; последнее давление, как мы видим, в 10 раз превышает начальное; скорость разложения при этом равна 0,018 сек. По расчетам Бертело и Вьеля, температура в момент взрыва доходит до 2750°. Еще более рельефные результаты получались с жидким ацетиленом. Взрывая накаленной проволокой в бомбе жидкий ацетилен при плотности заряжания 1/3 (18 г на 49 куб. стм), Бертело и Вьель получили давление 5564 кило на 1 кв. стм (такое давление примерно дает пироксилин в этих условиях). Стальной цилиндр с жидким ацетиленом при сильном ударе или при взрыве капсюля гремучей ртути взрывает; удар не действует на газообразный ацетилен, сжатый до 10 атм., даже, напр., при пробивании резервуара пулей. Опыты Бертело и Вьеля имеют важное значение для практики, так как на практике возможны случаи местного накаливания ацетилена и взрывы (могущей образоваться в присутствии аммиака) ацетиленистой меди; тогда может получиться взрыв ацетилена во всей, напр., городской газовой сети, сопровождаемый большим опустошением. Бертело и Вьель исследовали также одно интересное предложение, касающееся применения ацетилена для освещения, — это именно употребление раствора ацетилена в ацетоне. Ацетон, как уже сказано, растворяет при обыкновенных условиях около 25 объемов ацетилена, и количество растворенного ацетилена растет пропорционально давлению, уменьшаясь с повышением темп., при чем объем ацетона немного возрастает (на 0,04 на каждую атмосферу растворенного газа); если вычислить, как должен увеличиваться объем ацетона, считая растворенный ацетилен жидким, то найдем, что объем раствора меньше суммы объемов ацетона и ацетилена, т. е. — происходит сжатие. Благодаря большой растворимости ацетилена возможно в известном объеме ацетона иметь ацетилена значительно больше, чем сколько его может поместиться одного при том же объеме и том же давлении, или при определенном запасе ацетилена и одной и той же емкости резервуара для его хранения ацетонные растворы будут иметь значительно меньшее давление, и потому прочность их может быть значительно меньше. Бертело и Вьель изучили давление ацетонных растворов ацетилена в зависимости от темп. и концентрации. Напр., 1-й опыт: темп. 7,8°, давл. 5,6 кг на 1 кв. стм; 14° — 6,74 кг; 26° — 8,7 кг; 50,1° — 13,94 кг; 2-й опыт б,4° — 10,34 кг; 19,9° — 14,16 кг; 50,5° — 22,64 кг; 3-й опыт: 13° — 19,98 кг; 19,9° — 22,63 кг; 25° — 24,76 кг; 50,5° — 33,21. Из этих данных видно, что давления растут значительно медленнее, чем для жидкого ацетилена. Пробуя взрывать ацетонные растворы накаленной проволокой или гремучей ртутью, возбуждая взрыв в самой жидкости или в газе над жидкостью, Бертело и Вьель получили следующие результаты: при растворах, где давление ацетилена меньше 10 кг, может взрывать только один газ над жидкостью; растворенный же ацетилен не принимает участия во взрыве; взрыв гремучей ртути в жидкости не вызывает взрыва газообразного ацетилена. Если давление ацетилена более 10 кг, например растет до 20 кг, то взрывает весь ацетилен и получается эффект, напоминающий взрыв жидкого ацетилена.
Приборы, предложенные для добывания ацетилена, распадаются на три группы: в одной — на куски Углеродистый кальций* кальция вода каплет или течет струей, в других — Углеродистый кальций* кальций смачивается водой снизу, и в третьих — он бросается сразу в большое колич. воды. Оставляя в стороне два первых типа, как менее удовлетворительные, благодаря возможности получения очень высокой темп., которая может сопровождаться взрывом ацетилена, приведем несколько приборов 3-го типа. Загрузка Углеродистый кальций* кальция в одних делается вручную, в других автоматически. В одних аппаратах прибор для выделения ацетилена в то же время служит и газометром для хранения ацетилена; в других приборах газометр устраивается отдельно. Как образчик приборов последнего рода можно привести аппарат, патентированный Каро в 1900 г. Он состоит (фиг. 5) из ящика, наполненного водой, на ножках Р.
Фиг. 5.
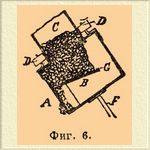
Дно ящика B наклонное — для удобного спуска известкового молока через кран F, f. К крышке ящика приделана труба С со щелью S, расширяющеюся книзу. В трубе С недалеко от поверхности воды устроена заслонка V с противовесом g, открывающаяся книзу. В верхней части трубы С устроено помещение для карбида D с заслонкой T, при помощи которой он может попасть через трубу С на решетку L. Для выхода ацетилена служит изогнутая трубка G с краном Е. Кран H служит для выпуска воздуха, k — для пополнения прибора водой; лаз M служит для чистки, трубка R — идет наружу в атмосферу. Для загрузки Углеродистый кальций* кальция предложено много остроумных автоматических приспособлений: в одних случаях он доставляется на роликах на бесконечном полотне, в других высыпается из вращающегося барабана, как, напр., на фиг. 6 — где С резервуар с карбидом, на который насажен вращающийся барабан В с неполной перегородкой G и щелью A.
Фиг. 6.
В некоторых случаях регулировка загрузки Углеродистый кальций* кальция достигается при помощи поплавков и т. д. Ацетилен перед горением очищается, обыкновенно пропусканием через раствор белильной извести. Для очищения ацетилена также патентовано много различных средств; одни предлагают смесь обыкновенной известки с белильной известью; другие хромовую кислоту (т. е. хромпик с серной кислотой и водой), смесь белильной извести с хромовокислым свинцом и пр. Предложенные вещества берут или в растворе, или в виде пористых тел и пр.
Из других применений ацетилена можно указать на предложение прибавлять его к светильному газу, чтобы увеличить светопроизводительную способность последнего, на применение его для фабрикации сажи и графита, для двигателей.
См. Ламанский, "Ацетилен"; Сапожников, "Ацетилен и ацетиленовое освещение" (1897); Dommer, "L'Ac étylè ne et ses applications"; Liebetanz, "Calciumcarbid u. Acetylen"; статьи Berthelot et Vielle в "Ann. Ch. Phys." (1897); Lunge, Baroberger и др. в "Zeits. f. angev. Chemie", журн. "Acetylen" и пр..
С. Вуколов. Δ .
|
Смотрии так же... |
|