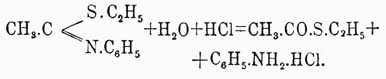Тиокислоты
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Т | ТА | ТВ | ТЕ | ТЁ | ТЗ | ТИ | ТК | ТЛ | ТМ | ТО | ТР | ТС | ТУ | ТХ | ТЦ | ТШ | ТЩ | ТЫ | ТЬ | ТЭ | ТЮ | ТЯ |
| ТИА |
| ТИБ |
| ТИВ |
| ТИГ |
| ТИД |
| ТИЕ |
| ТИЗ |
| ТИИ |
| ТИК |
| ТИЛ |
| ТИМ |
| ТИН |
| ТИО |
| ТИП |
| ТИР |
| ТИС |
| ТИТ |
| ТИУ |
| ТИФ |
| ТИХ |
| ТИЦ |
| ТИЧ |
| ТИШ |
| ТИЩ |
| ТИЯ |
Тиокислоты (хим.) — R—CO—SH, где R углеводородный остаток. Отвечают по составу обыкновенным карбоновым кислотам, в которых кислород гидроксильной группы в карбоксиле замещен серой. Теория предвидит еще существование двух других рядов Тиокислоты — изо-Тиокислоты R—CS—OH и ди-Тиокислоты R—CS—SH, но последние не получены в жирном ряду, а изокислоты известны лишь в виде производных (см. Тиоамиды). Во всех этих соединениях сера двухатомна. Тиокислоты открыты Кекуле и образуются путем следующих реакций: 1) действие пятисернистого фосфора на карбоновые кислоты, за исключением муравьиной, или сульфгидрата калия на их хлорангидриды, напр.: 5CH 3 —СООН + P 2S5 = 5СН 3—CO—SH + P2O5; СН 3 —СОСl + КSН = СН 3 —СОSН + КСl; 2) действие спиртового раствора сульфгидрата калия на сложные эфиры фенола, напр.: СН 3 —СО—О—С 6H5 + KSH = CH3—CO—SK + С 6 Н 5 —ОН. Свободные Тиокислоты представляют бесцветные жидкости с отвратительным запахом, кипящие ниже соответствующих им кислородных соединений (тиоуксусная кислота, напр., кип. при 93°), как все сульфгидраты (см.), и мало растворимые в воде. Они легко образуют соли; соли щелочных металлов легко растворимы в воде и хорошо кристаллизуются; соли тяжелых металлов легко разлагаются с выделением сернистого металла, на чем основано применение тиоуксуснокислого аммония для осаждения металлов IV и V групп при анализе, предложенное Шиффом. Павлевский предлагает употреблять Тиокислоты для ацетилирования различных органических амидосоединений: при действии на последние тиоуксусной кислоты происходит выделение сероводорода и замещение водорода амидной группы ацетилом. При электролизе Тиокислоты на аноде выделяются их дитиоангидриды, напр.
2СН 3 —COSH = (СН 3 —СОS) 3 + Η 2. Из производных Тиокислоты, кроме солей, известны тиоангидриды, дитиоангидриды и сложные эфиры. Тиоангидриды образуются при действии сернистого фосфора на соответствующие кислородные соединения или при обработке свинцовых солей Тиокислоты хлорангидридами, напр.: 2СН 3 —СОСl + Рb(S—СО—СН 3)2 = PbCl2 + 2(СН 3 —СО) 2 S.
Вода медленно разлагает их на кислоты и Тиокислоты:
(СН 3 —СО) 2 S + Н 2 О = СН 3 —СООН + СН 3 —СОSН.
Дитиоангидриды Т. аналогичны органическим перекисям, но гораздо прочнее их. Они образуются при действии йода на соли Тиокислоты:
2СН 3 —СО—SNa + J 2 = (СН 3—COS)2 + 2NaJ
а также при электролизе Тиокислоты (см. выше). Сложные эфиры Т. тождественны с эфирами кислородных кислот и тиоспиртов и непосредственно не образуются (ср. Тиоспирты). Для их получения действуют хлорангидридами кислот на меркаптиды, напр.:
2СН 3 —СОСl + Рb(S—СН 3)2 = 2СН 3 —СО—S—СН 3 +PbCl2.
Они образуются также при действии меркаптидов натрия на сложные эфиры фенола — аналогично такому же способу получения самих Тиокислоты (см. выше), напр.:
CH3—CO—O—C6H5 + Nа 2 S—С 2H5 = СН 3 —СО—S—C 2H5 + С 6 Н 5 ОNа
и, наконец, при разложении точно отвешенным колич. кислоты фениимидотиоэфиров, напр.:
Д. Монастырский. Δ .
|
Смотрии так же... |
|