Сорбиновая кислота
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| С | СА | СБ | СВ | СГ | СД | СЕ | СЖ | СИ | СК | СЛ | СМ | СН | СО | СП | СР | СС | СТ | СУ | СФ | СХ | СЦ | СЧ | СЪ | СЫ | СЬ | СЭ | СЮ | СЯ |
| СОУ |
| СОА |
| СОБ |
| СОВ |
| СОГ |
| СОД |
| СОЕ |
| СОЖ |
| СОЗ |
| СОИ |
| СОЙ |
| СОК |
| СОЛ |
| СОМ |
| СОН |
| СОО |
| СОП |
| СОР |
| СОС |
| СОТ |
| СОУ |
| СОФ |
| СОХ |
| СОЦ |
| СОЧ |
| СОШ |
| СОЮ |
| СОЯ |
Сорбиновая кислота C6H8O2 = СН 3.СН:СН.СН:СН.СООН, найдена Гофманом в соке ягод незрелой рябины. К соку рябины прибавляют небольшое количество извести и раствор отчасти выпаривают. В осадке образуется кислая кальциевая соль яблочной кислоты. Жидкость фильтруют и, разложив фильтрат серной кисл., перегоняют. Дистиллят нейтрализуют содой, выпаривают и разлагают серной кислотой. Получающийся в виде масла лактон парасорбиновой кислоты 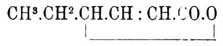 при нагревании со щелочью или кислотой дает Сорбиновая кислота кислоту. Очищается Сорбиновая кислота кислота кристаллизацией из кипящей смеси одного объема спирта и двух объемов воды. Сорбиновая кислота кислота кристаллизуется в виде длинных белых иголок, плавится при 134,5°, кипит с разложением при 228°, с водяным паром перегоняется без разложения, хорошо растворяется в спирте и эфире, почти не растворима в холодной воде и мало в горячей. Одноосновность Сорбиновая кислота кислоты доказывается способностью ее давать один ряд солей, напр. Са(C 6 Н 7O2)2 и один ряд эфиров, напр. С 6 Н 7 О 2.С 2 Н 5 —этиловый эфир Сорбиновая кислота кислоты, кипящий при 195,5°. Непредельность Сорбиновая кислота кислоты вытекает из способности ее к присоединению двух или четырех, смотря по условиям опыта, атомов брома и двух частиц бромистого водорода. Строение Сорбиновая кислота кислоты доказано окислением ее марганцовокислым калием в уксусный альдегид и виноградную кислоту, а а также синтезом ее из кротонового альдегида и малоновой кислоты в присутствии пиридина:
при нагревании со щелочью или кислотой дает Сорбиновая кислота кислоту. Очищается Сорбиновая кислота кислота кристаллизацией из кипящей смеси одного объема спирта и двух объемов воды. Сорбиновая кислота кислота кристаллизуется в виде длинных белых иголок, плавится при 134,5°, кипит с разложением при 228°, с водяным паром перегоняется без разложения, хорошо растворяется в спирте и эфире, почти не растворима в холодной воде и мало в горячей. Одноосновность Сорбиновая кислота кислоты доказывается способностью ее давать один ряд солей, напр. Са(C 6 Н 7O2)2 и один ряд эфиров, напр. С 6 Н 7 О 2.С 2 Н 5 —этиловый эфир Сорбиновая кислота кислоты, кипящий при 195,5°. Непредельность Сорбиновая кислота кислоты вытекает из способности ее к присоединению двух или четырех, смотря по условиям опыта, атомов брома и двух частиц бромистого водорода. Строение Сорбиновая кислота кислоты доказано окислением ее марганцовокислым калием в уксусный альдегид и виноградную кислоту, а а также синтезом ее из кротонового альдегида и малоновой кислоты в присутствии пиридина:
СН 3.СН:СН.CHO + СН 2 (СООН) 2 = CH3.CH:СН.СН:СН.СООН + СО 2 + Н 2O.
При восстановлении Сорбиновая кислота кислоты амальгамой натрия получается гидросорбиновая кислота CH 3.CH2.CH:CH.CH2.CO2 H, строение которой доказано синтезом из янтарно-кислого натрия и пропионового альдегида в присутствии уксусного ангидрида. Факт образования гидросорбиновой кислоты указанного строения из Сорбиновая кислота кислоты, с одной стороны, подтверждает нормальное строение Сорбиновая кислота кислоты, с другой же стороны, является как бы противоречием указанному выше расположению двойных связей в Сорбиновая кислота кислоте, так как при восстановлении СН 3.СН:СН.СН:СН.СООН должны были бы нормально получаться СН 3.СН:СН.CH 2.СН 2.COОН. или СН 3.СН 2.СН 2.СН:СН.СООН. Такое ненормальное присоединение водорода вообще не единственное. Тиле собрал много фактов, где две двойные связи в цепи, разделенные друг от друга одной одиночной, при соединении с двумя атомами водорода или брома перемещают двойную связь в середину, напр.:
СН 2:СН.СН:CH 2 + Br2 = СН 2 Вr.СН:СН.СН 2Br.
Явление это Тиле старается объяснить теорией остаточных сродств (см. Химическое сродство). В самое последнее время теория Тиле дала повод Кнёвенагелю попытаться видоизменить стереохимические представления (см. Стереохимия). Кислоты изомерные Сорбиновая кислота кислоте — пропилацетиленкарбоновая СН 3.СН 2.СН 2.С≡Сорбиновая кислотаСООН и изосорбиновая (СН 3)2 CH.C≡Сорбиновая кислотаСООН — получены А. Е. Фаворским при пропускании углекислоты для первой через натровое производное пропилацетилена, для второй — через натровое производное изопропилацетилена. Первая кристаллизуется в перистых кристаллах и плавится при 27°, вторая — при 38°.
К. A. Красуcкuй. Δ.
|
Смотрии так же... |
|