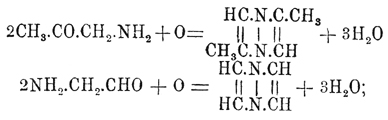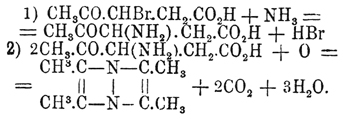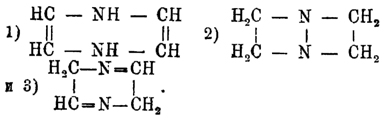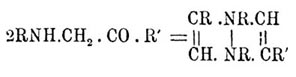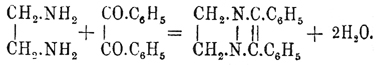Пиразины
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| П | ПЕ | ПА | ПЕ | ПЁ | ПЖ | ПИ | ПЛ | ПН | ПО | ПП | ПР | ПС | ПТ | ПУ | ПФ | ПХ | ПЧ | ПШ | ПЫ | ПЬ | ПЭ | ПЮ | ПЯ |
| ПИА |
| ПИБ |
| ПИВ |
| ПИГ |
| ПИД |
| ПИЕ |
| ПИЖ |
| ПИЗ |
| ПИИ |
| ПИЙ |
| ПИК |
| ПИЛ |
| ПИМ |
| ПИН |
| ПИО |
| ПИП |
| ПИР |
| ПИС |
| ПИТ |
| ПИУ |
| ПИФ |
| ПИХ |
| ПИЦ |
| ПИЧ |
| ПИШ |
| ПИЩ |
| ПИЭ |
| ПИЯ |
Пиразины Вернее, пирадиазины, иногда также называются пиазинами — могут быть рассматриваемы как ароматические углеводороды, в которых две группы СН бензольного кольца, находящиеся в пара-положении, замещены двумя атомами азота, следовательно, конституционная формула простейшего из них будет 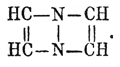 . По своему химическому характеру Пиразины являются весьма слабыми двухатомными основаниями, соли которых легко разлагаются содой и имеют нейтральную реакцию. Характерны для Пиразины их двойные соли с HgCl 2, AuCl3, которые приближают их к пиридинам (см.) и к истинным аммиачным основаниям. При восстановлении натрием в спиртовом растворе Пиразины присоединяют 3Н 2 и переходят в пиперазины. Простейшие Пиразины образуются: 1) конденсацией амидокетонов или амидоальдегидов с выделением 2 частиц воды и одновременным окислением образующегося первоначально продукта конденсации при помощи сулемы HgCl 2; вместо амидокетонов можно брать изонитрозокетоны, их восстановить и, не изолируя продукта восстановления, прямо перегонять полученный раствор с сулемой:
. По своему химическому характеру Пиразины являются весьма слабыми двухатомными основаниями, соли которых легко разлагаются содой и имеют нейтральную реакцию. Характерны для Пиразины их двойные соли с HgCl 2, AuCl3, которые приближают их к пиридинам (см.) и к истинным аммиачным основаниям. При восстановлении натрием в спиртовом растворе Пиразины присоединяют 3Н 2 и переходят в пиперазины. Простейшие Пиразины образуются: 1) конденсацией амидокетонов или амидоальдегидов с выделением 2 частиц воды и одновременным окислением образующегося первоначально продукта конденсации при помощи сулемы HgCl 2; вместо амидокетонов можно брать изонитрозокетоны, их восстановить и, не изолируя продукта восстановления, прямо перегонять полученный раствор с сулемой:
образующиеся соединения по исходным материалам называют также алдинами и кетинами; 2) конденсацией в присутствии аммиака и последующим окислением α-хлор- или бромкетосоединений; очевидно, что этот синтез основан на промежуточном образовании амидокетонов:
Дифенилпиразины получаются из производных дифенилдигидропиразинов. Представителями простейших Пиразины могут служить Пиразины C4H4N2, твердое кристаллическое вещество, пахнущее гелиотропом, летучее при обыкн. темп., плавящееся при 55° и кипящее при 115°, αγ -диметилпиразин, или кетин С 4 Н 2 (СН 2)N2, масло, кипящее при 153°, и αγ -дифенилпиразин, плавящийся при 196° и не перегоняющийся без разложения. При окислении марганцово-калиевой солью гомологов Пиразины с жирными боковыми цепями получаются пиразинкарбоновые кислоты, характерные тем, что они при простом нагревании выделяют углекислоту и переходят в Пиразины Раньше было указано, что при восстановлении в щелочном растворе Пиразины переходят в гексагидропиразины, или пиперазины. Но теоретически допустимы и промежуточные стадии гидрогенизации; они в действительности и получены, хотя и не прямым путем. Теоретически возможны три вида дигидропиразинов:
Первые получаются конденсацией 2 частиц замещенных α-амидокетонов или 2 част. α-бромкетонов с 2 част. первичных аминов или анилинов; очевидно, что второй способ является только видоизменением первого:
Из этого класса соединений интересны только фенильные производные, напр., п-дибензил-α, γ - дифенилдигидропиразин, в котором R = С 6H4 —СН 3 и R' = C 6 H5. Эти соединения легко отщепляют группы R и переходят в дифенилпиразины. Соединения, принадлежащие ко второму типу дигидропиразинов, получаются из этилендиамина и 1,2-дикетонов:
α, γ-Дигидропиразины до сих пор еще не получены. Из возможных двух типов тетрагидропиразинов известен только один в виде своего производного п-дифенилтетрагидрофенилпиразина 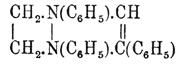 , который получается конденсацией этилендифенилдиамина с бромацетофеноном. CH 2Br.CO.C6H5. Гексагидропиразины, или пиперазины, представляют уже вполне насыщенные соединения и потому по своему химическому характеру отвечают соответствующим жирным соединениям, т. е. они являются уже типическими жирными дииминами, или вторичными диаминами (см.), и настолько же далеко отстоят от Пиразины, насколько гексагидроароматические соединения от ароматических. Пиперазины получаются или восстановлением Пиразины натрием в спиртовом растворе, или конденсацией хлористоводородных солей алкилендиаминов, или же, наконец, конденсацией первичных аминов и алкилендиаминов с дибромэтиленом:
, который получается конденсацией этилендифенилдиамина с бромацетофеноном. CH 2Br.CO.C6H5. Гексагидропиразины, или пиперазины, представляют уже вполне насыщенные соединения и потому по своему химическому характеру отвечают соответствующим жирным соединениям, т. е. они являются уже типическими жирными дииминами, или вторичными диаминами (см.), и настолько же далеко отстоят от Пиразины, насколько гексагидроароматические соединения от ароматических. Пиперазины получаются или восстановлением Пиразины натрием в спиртовом растворе, или конденсацией хлористоводородных солей алкилендиаминов, или же, наконец, конденсацией первичных аминов и алкилендиаминов с дибромэтиленом:
1) C4H4N2 + 3Н 2 = C4H10N2;
2) 2HClNH2—CH2CH2NH2—HCl = HCl—NH=(CH2—CH2)2=NH—HCl + 2NH4Cl;
3a) 2ВrСН 2 СН 2Br + 2C6H5NH2 = C6H5N=(CH2CH2)=NC6H5 + 4HBr
3b) NH2CH2CH2NH2 + BrCH2CH2Br = HBrNH=(CH2CH2)2=NH—HBr.
Простейший член этого ряда соединений, пиперазин, или диэтилендиамин, NH=(CH2—CH2)NH, был впервые получен в 1856 г. Натансоном из хлористого этилена и аммиака. Пиперазин кристаллизуется из спирта в ромбич. листочках, плав. при 104° и перегоняется при 145—146° без разложения. Получать его можно всеми вышеуказанными для пиперазина реакциями, но легче всего, по-видимому, разложением щелочами динитрозо-п-дифенилпиперазина, который при этом распадается на 2 мол. нитрозофенола и пиперазин. Действуя монохлороуксусной или щавелевой кислотами на замещенные этилендиамины или конденсируя замещенные глицины, можно получить кето- и дикетопиперазины, весьма тщательно исследованные Бишоффом. Бензо-Пиразины — см. Хиноксалины.
Д. А. Хардин. Δ .
|
Смотрии так же... |
|