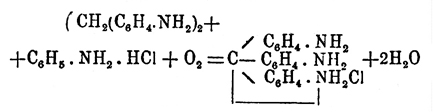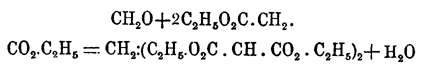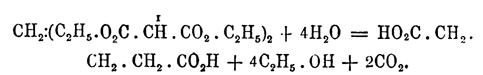Оксиметилен
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| О | ОА | ОБ | ОВ | ОГ | ОД | ОЕ | ОЖ | ОЗ | ОИ | ОЙ | ОК | ОЛ | ОМ | ОН | ОО | ОП | ОР | ОС | ОТ | ОУ | ОФ | ОХ | ОЦ | ОЧ | ОШ | ОЩ | ОЭ | ОЯ |
| ОКА |
| ОКБ |
| ОКЕ |
| ОКИ |
| ОКК |
| ОКЛ |
| ОКН |
| ОКО |
| ОКР |
| ОКС |
| ОКТ |
| ОКУ |
| ОКЦ |
Оксиметилен (хим. Oxymethylen). — В 1859 г. А. М. Бутлеров, занимаясь изучением полученного им йодистого метилена, открыл новое вещество, которое возникает при взаимодействии этого йодюра с щавелевокислым серебром:
CH2I2 + Ag2C2O4 = CH2 O + 2AgI + СО 2 + СОксиметилен
Реакция начинается при слабом подогревании, но идет затем настолько энергично, что необходимо для урегулирования ее предварительное прибавление порошкообразного стекла или, что лучше, перегнанного керосина. Такой же продукт может быть получен и при действии окиси серебра на йодистый метилен: CH 2I2 + Ag2O = CH2 O + 2AgI. Это белая, неясно кристаллическая масса, при обыкновенной температуре почти непахучая, но при нагревании развивающая характерный резкий запах, сильно раздражающий слизистые оболочки носа и вызывающий слезы. Уже при 100° замечается значительная летучесть, получается белый просвечивающий возгон, а при высшей температуре происходит быстрое улетучивание без предварительного плавления. Это соединение нерастворимо в воде, спирте или эфире, но если нагревать его с водой в запаянной трубке при 100°, то растворение медленно совершается, при 130°-150° оно идет быстрее; из полученного раствора, испаряя его в пустоте, можно снова выделить неизмененное вещество; раствор обладает тем же резким запахом, который свойствен нагретому твердому соединению. Бутлеров придал этому веществу удвоенную формулу, на основании ошибочного определения плотности пара, C 2H4O2, и назвал его диоксиметиленом [В лаборатории Бутлерова твердый полимер назывался также окисью метилена.]. Позднее (1869) А. В. Гофманн получил то же соединение при окислении воздухом метилового спирта. Он пропускал через подогретый спирт воздух; окисление совершалось затем при соприкосновении смеси паров спирта и воздуха с накаленной платиновой спиралью; в охлажденном приемнике получался водный раствор нового вещества и не окислившегося спирта. По способу происхождения и по всем отношениям Гофманн назвал его формальдегидом или муравьиным альдегидом: СН 3.ОН + О = СН 2O + H2 Оксиметилен Определение плотности пара показало, что частица его проста — СН 2 О; но по охлаждении прибора, в котором производилось это определение, происходит медленное уменьшение объема и осаждение твердого тела, очевидно, полимерного видоизменения альдегида, которое тожественно с соединением Бутлерова и которому Гофманн придал формулу утроенную (СН 2 О) 3, по аналогии с тиоформальдегидом (СН 2S)3 [Это соединение получается (Гофманн) лучше всего при насыщения сероводородом смеси 1 объема продажного формальдегида (40% раствор) и 2-8 объемов крепкой соляной кислоты; кристаллизуется из бензола в бесцветных квадратных призмах, не обладает запахом, если чисто; температура плавления 216°, летуче без разложения]; частичный вес последнего определен и по плотности пара, и по понижению температуры замерзания растворов. Криоскопический метод (Толленс и Ф. Майер, 1888) показал, что формальдегид и в слабых водных растворах присутствует в виде мономера; в крепких же он уже полимеризован, именно (СН 2 О) 2 и по разбавлении снова превращается в СН 2 О — при стоянии (через 1 час). Толленс отличает пара— и метаформальдегид, разновидности полимеризованного альдегида — растворимую в воде и нерастворимую; последняя тождественна с Оксиметилен Бутлерова. А. Кекуле в 1892 г. открыл, наконец, формальдегид в жидком состоянии, неполимеризованный; получив его в виде пара нагреванием сухого Оксиметилен, он подверг сильному охлаждению, смесью твердой углекислоты и эфира, этот пар, который сгустился в водянистую, легко подвижную жидкость, кипящую при —21° (в жидкости было —20, 5°, в парах —21,6°). Жидкий формальдегид имеет удельный вес 0,9172 при —80° и 0,8153 при —20°, т. е. коэффициент его расширения очень большой; полимеризация его довольно быстро, но спокойно совершается уже при —20°; нагретый до комнатной температуры, он сильно разогревается и с треском превращается в твердое видоизменение. Название "формальдегид" в настоящее время почти совершенно вытеснило данное Бутлеровым; к тому же слово Оксиметилен употребляется ныне и для обозначения двуэквивалентной группы  . Таким образом, простейший альдегид отличается от всех других членов этого класса соединений чрезвычайной способностью к полимеризации; как мономер, он доступен в сущности только в виде раствора. За последние 15 лет Оксиметилен часто подвергался исследованиям и получил многие технические применения. В виде раствора он готовится фабричным путем (40% водный раствор), для чего обыкновенно применяется реакция Гофманна; окисление метилового спирта воздухом совершается или при содействии платины, или окиси меди; поступают, например, так: быстрый ток воздуха просасывается водяным насосом через крепкую серную кислоту, для сушения, затем через нагретый до 45°-50° спирт; смесь паров его и воздуха входит в стеклянную трубку (30 см. длины), в которой помещена пробка длиной в 6 см. из грубой медной сетки, окисленная с поверхности; эта часть трубки, окруженная и снаружи сеткой, умеренно нагревается; начавшаяся реакция производит раскаливание медной пробки, которое остается во все время операции; продукты поступают затем в ряд приемников — два первых из них пустые, а затем два с водой; в первом приемнике получается 30-40% раствор Оксиметилен, содержащий еще не окислившийся спирт и немного муравьиной кислоты (продукта окисления альдегида), это так называемый Rohformaldehyd; из последнего приемника насос выкачивает азот и не вошедший в реакцию кислород, а также CO, которая может образоваться при окислении. В начале 80-х гг. в университетской лаборатории Бутлерова окисляли метиловый спирт в приборе, подобном вышеописанному, но при содействии платинированного асбеста (способ Каблукова, разработанный в той же лаборатории), операция велась непрерывно целыми днями при очень хороших выходах. Оксиметилен способен ко всем тем превращениям, которые свойственны вообще альдегидам. Но в некоторых случаях он представляет весьма интересные особенности. Бутлеров получил (1861) из него впервые сахаристое вещество, которое он назвал метиленитаном; спустя 25 лет, Лёв, изучая это превращение, получил формозу С 6 Н 12O6 (см.), сахаристое вещество, которое не содержало примесей иного характера, каковые находились в метиленитане; Лёв действовал известковой водой на раствор Оксиметилен при обыкновенной температуре, а Бутлеров — при нагревании. Способность Оксиметилен превращаться в сахаристые вещества обуславливает, быть может, его роль при синтезе углеводов в растениях, как промежуточного члена в ряду других веществ, последовательно образующихся при этом процессе (гипотеза А. Байера). Если поместить водоросль Spirogyra, лишенную крахмала, в раствор, содержащий фосфорнокислый натрий и соединение Оксиметилен с сернистокислым натрием [Свободный Оксиметилен убивает водоросль.] СН 2 (ОН).SО 3 Nа + Н 2 О, и выставить, в закрытом сосуде, на солнечный свет, то в клеточках водоросли происходит обильное образование зерен крахмала (Бокорни). Этот интересный опыт подтверждает предположение Байера, но, однако, Оксиметилен до сих пор еще не был найден в растениях. Другое превращение Оксиметилен, открытое (1860) Бутлеровым — это реакция с аммиаком: 6СН 2 О + 4NН 3 = С 6 Н 12N4 + 6Н 2 О, которая идет весьма легко в водном растворе и до конца, так что можно пользоваться ею для определения количества Оксиметилен, употребляя титрованный раствор аммиака и определяя избыток его титрованием кислотой, с лакмусом в качестве индикатора. Продукт реакции C 6H12N4, так называемый гексаметилентетрамин кристаллизуется из воды в блестящих ромбоэдрах, при нагревании имеет очень неприятный запах и с кислотами дает соли (с одним эквивалентом кислоты, например С 6 Н 12N4.HCl), которые в водном растворе относятся к лакмусу, как свободные кислоты. При взаимодействии Оксиметилен с галоидоводородными кислотами совершается такая реакция (В. Тищенко):
. Таким образом, простейший альдегид отличается от всех других членов этого класса соединений чрезвычайной способностью к полимеризации; как мономер, он доступен в сущности только в виде раствора. За последние 15 лет Оксиметилен часто подвергался исследованиям и получил многие технические применения. В виде раствора он готовится фабричным путем (40% водный раствор), для чего обыкновенно применяется реакция Гофманна; окисление метилового спирта воздухом совершается или при содействии платины, или окиси меди; поступают, например, так: быстрый ток воздуха просасывается водяным насосом через крепкую серную кислоту, для сушения, затем через нагретый до 45°-50° спирт; смесь паров его и воздуха входит в стеклянную трубку (30 см. длины), в которой помещена пробка длиной в 6 см. из грубой медной сетки, окисленная с поверхности; эта часть трубки, окруженная и снаружи сеткой, умеренно нагревается; начавшаяся реакция производит раскаливание медной пробки, которое остается во все время операции; продукты поступают затем в ряд приемников — два первых из них пустые, а затем два с водой; в первом приемнике получается 30-40% раствор Оксиметилен, содержащий еще не окислившийся спирт и немного муравьиной кислоты (продукта окисления альдегида), это так называемый Rohformaldehyd; из последнего приемника насос выкачивает азот и не вошедший в реакцию кислород, а также CO, которая может образоваться при окислении. В начале 80-х гг. в университетской лаборатории Бутлерова окисляли метиловый спирт в приборе, подобном вышеописанному, но при содействии платинированного асбеста (способ Каблукова, разработанный в той же лаборатории), операция велась непрерывно целыми днями при очень хороших выходах. Оксиметилен способен ко всем тем превращениям, которые свойственны вообще альдегидам. Но в некоторых случаях он представляет весьма интересные особенности. Бутлеров получил (1861) из него впервые сахаристое вещество, которое он назвал метиленитаном; спустя 25 лет, Лёв, изучая это превращение, получил формозу С 6 Н 12O6 (см.), сахаристое вещество, которое не содержало примесей иного характера, каковые находились в метиленитане; Лёв действовал известковой водой на раствор Оксиметилен при обыкновенной температуре, а Бутлеров — при нагревании. Способность Оксиметилен превращаться в сахаристые вещества обуславливает, быть может, его роль при синтезе углеводов в растениях, как промежуточного члена в ряду других веществ, последовательно образующихся при этом процессе (гипотеза А. Байера). Если поместить водоросль Spirogyra, лишенную крахмала, в раствор, содержащий фосфорнокислый натрий и соединение Оксиметилен с сернистокислым натрием [Свободный Оксиметилен убивает водоросль.] СН 2 (ОН).SО 3 Nа + Н 2 О, и выставить, в закрытом сосуде, на солнечный свет, то в клеточках водоросли происходит обильное образование зерен крахмала (Бокорни). Этот интересный опыт подтверждает предположение Байера, но, однако, Оксиметилен до сих пор еще не был найден в растениях. Другое превращение Оксиметилен, открытое (1860) Бутлеровым — это реакция с аммиаком: 6СН 2 О + 4NН 3 = С 6 Н 12N4 + 6Н 2 О, которая идет весьма легко в водном растворе и до конца, так что можно пользоваться ею для определения количества Оксиметилен, употребляя титрованный раствор аммиака и определяя избыток его титрованием кислотой, с лакмусом в качестве индикатора. Продукт реакции C 6H12N4, так называемый гексаметилентетрамин кристаллизуется из воды в блестящих ромбоэдрах, при нагревании имеет очень неприятный запах и с кислотами дает соли (с одним эквивалентом кислоты, например С 6 Н 12N4.HCl), которые в водном растворе относятся к лакмусу, как свободные кислоты. При взаимодействии Оксиметилен с галоидоводородными кислотами совершается такая реакция (В. Тищенко):
1) СН 2 О + 2HG = CH 2G2;
2) СН 2 O + СН 2G2 + H2 О = СН 3.G + СНО 2.H + HG;
из двух частиц Оксиметилен получается частица галоидангидрида метилового спирта и частица муравьиной кислоты. Хлор с Оксиметилен дает фосген и хлористый водород (на солнечном свету): СН 2 О + 2Cl 2 = COCl2 + 2HCl; реакция с йодом и бромом того же характера, но маскируется некоторыми побочными продуктами (Тищенко). По способу Е. Е. Вагнера, альдегиды R'.CHO при взаимодействии с цинкоорганическими соединениями и затем с водой могут быть превращены во вторичные спирты; Оксиметилен таким путем дает первичные:
1) CH2O + ZnR'2 = R'.СН 2.ОксиметиленZn.R';
2) R'. СH 2.ОксиметиленZn.R' + 2Н 2 О = R'.CH 2.ОН + Zn(OH) 2 + R'.H;
были получены по этому способу пропиловый и нормальный бутиловый спирты (Тищенко). Отношение Оксиметилен к аминам того же рода, как и к самому аммиаку; реакция идет с выделением воды, кислород для которой доставляется Оксиметилен, а водород — амином и именно тот, который соединен с азотом; ввиду этого третичные амины не реагируют с Оксиметилен, а только вторичные и первичные; были получены (С. Колотов) из диэтиламина — тетрэтилметилендиамин (С 2 Н 5)4N2:СН 2 из этиламина — этилметиленамин C2H5.N:CH2 из анилина — фенилметиленамин C6H5.N:CH2 [Все эти вещества способны давать соли, хлороплагинаты, но очень легко (и обратно образованию) разлагаются кислотами, особенно при нагревании, как и гексаметиленамин Бутлерова; молекулярный вес первых двух определен по плотности пара — они мономерны. Фенилметиленамин оказался тримером, что установлено (Гофер) криоскопическим путем. При действии Оксиметилен на свободный фенилгидразин получается (Толленс, 1885) кристаллический продукт состава 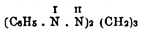 с температурой плавления 184°, а с хлористоводородным фенилгидразином получается продукт того же состава, но с температурой плавления 112° (Гольдшмидт, 1896). Об оксиме см. Изонитрозосоединения.]. Последний одновременно был получен Толленсом, который назвал его ангидроформальдегиданилином; это вещество при нагревании с анилином дает диамидодифецилметан: С 6H5.N:СН 2 + C6H5.NH2 = СН 2(C6H4.NH2)2, а затем с хлористоводородным анилином в присутствии окислителя соль пара-розанилина (p-Fuchsin)
с температурой плавления 184°, а с хлористоводородным фенилгидразином получается продукт того же состава, но с температурой плавления 112° (Гольдшмидт, 1896). Об оксиме см. Изонитрозосоединения.]. Последний одновременно был получен Толленсом, который назвал его ангидроформальдегиданилином; это вещество при нагревании с анилином дает диамидодифецилметан: С 6H5.N:СН 2 + C6H5.NH2 = СН 2(C6H4.NH2)2, а затем с хлористоводородным анилином в присутствии окислителя соль пара-розанилина (p-Fuchsin)
При помощи Оксиметилен получаются в настоящее время и многие другие красящие вещества. Некоторые вещества предельного ряда, обладающие "подвижными" атомами водорода, точно также вступают во взаимодействие с Оксиметилен; например, малоновый эфир при содействии небольшого количества диэтиламина или пиперидина (Кнёвенагель):
полученный метилендималоновый эфир кипячением с соляной кислотой может быть переведен в глутаровую кислоту:
Таким образом Оксиметилен является, по своей способности к взаимодействиям, весьма ценным средством для синтезов очень разнообразных. Для подобных конденсаций, в тех случаях, когда нужно избегать присутствия воды, нельзя брать Оксиметилен, так как обыкновенно он имеется в водном растворе; тогда берут производное Оксиметилен так называемый метилал СН 2 (ОксиметиленСН 3)2, жидкость эфирного характера, с температурой кипения 42°; это вещество получается при окислении метилового спирта перекисью марганца с серной кислотой; оно растворимо в эфире, в спирте и, трудно, в воде. Возможность употребления метилала вместо Оксиметилен явствует из следующего общего уравнения: 2Х.Н+СН 2 (ОксиметиленСН 3)2 =Х.СН 2.Х+2СН 3.ОН; разница только та, что реакция идет с выделением метилового спирта, а не воды. Из метилала может быть приготовлен и Оксиметилен в водном растворе — кипячением с разведенной серной кислотой и перегонкой: СН 2 (ОксиметиленСН 3)2+H2 O=СН 2 О+2СН 3.ОН. Водный раствор Оксиметилен, под именем формалина, применяется как дезинфицирующее и консервирующее средство (сохранение медицинских препаратов, бальзамирование); дезинфекция книг, платья производится в особых шкафах газообразным Оксиметилен, который выделяется из особых плиток (формалит); они готовятся из кизель-гура и напитываются раствором Оксиметилен
С. С. Колотов. Δ .
|
Смотрии так же... |
|