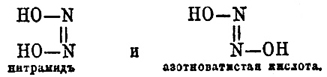Нитроамины
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Н | НА | НГ | НЕ | НЁ | НИ | НО | НР | НУ | НЫ | НЬ | НЭ | НЮ | НЯ |
| НИА |
| НИБ |
| НИВ |
| НИГ |
| НИД |
| НИЕ |
| НИЖ |
| НИЗ |
| НИЙ |
| НИК |
| НИЛ |
| НИМ |
| НИН |
| НИО |
| НИП |
| НИР |
| НИС |
| НИТ |
| НИФ |
| НИЦ |
| НИЧ |
| НИШ |
| НИЩ |
| НИЯ |
Нитроамины (хим.) — открытые Франшимоном соединения, которые можно называть также замещенными амидами азотной кислоты, т. е. H 2N.NO2, в котором один или оба водородных атома замещены R 1', R'2 — одноэквивалентными углеводородными радикалами. Получаются Нитроамины, именно R'NH.NO 2, из различных замещенных амидов через предварительное их нитрование возможно крепкой азотной кислотой и расщепление полученного нитропродукта в эфирном растворе действием аммиака, при чем осаждается аммонийная соль Нитроамины, напр.: метилуретан СН 3.NНитроаминыСО.О.СН 3 → СН 3N(NO2).CО.О.СН 3 → СН 3.NH.NO2 — метилнитроамин, выделяемый из аммонийной соли кипячением со спиртом; или таким же путем этот простейший Нитроамины можно получить из диметилоксамида CH 3.HN.CO.CO.NH.CH3. Кристаллический CH 3.NH.NO2 плавится при 38°, C 2H5.NH.NO2 — при 3°; высшие суть жидкости, более или менее трудно застывающие, [(CH 3)2CH].NH.NO2 плавится при — 4° и CH 3.CH2.CH2.NH.NO2 — около — 22°, и кипящие при уменьшенном давлении (10 — 15 мм) без разложения при 90° — 130°. Они обладают кислой реакцией и дают соли; СН 3.N(NО 2).К кристаллизуется в тонких иглах и взрывает весьма сильно при нагревании и при ударе. Двузамещенные амиды азотной кислоты R' 2N.NO2 или Нитроамины из вторичных аминов получаются при действии крепкой азотной кислоты на двузамещенные мочевины —
(R')2 N.СО.NН 2 → R'N.NO2
или при нагревании R'.NH.NO 2 с R'.J и спиртовым раствором едкого кали, т. е. по уравнению:
R'N(NO2)K + R'.J = KJ + R'2N.NO2.
Диметилнитроамин (CH3)2N.NO2 кристалличен, темп. плав. 57 — 58°, кипит при 187°; (C 2H5)2N.NO2 жидок, кипит при 206,5°; высшие (R' = С 3 Н 7) члены ряда перегоняются при уменьшенном давлении; эти вещества уже не обладают кислотными свойствами и при восстановлении (цинковая пыль и уксусная кислота) дают несимметрично замещенные гидразины, например (CH 3)2N.NH2.
Простейшим представителем этого рода соединений в ароматическом ряду можно считать так называемую диазобензоловую кислоту (C6H5.NH.NO2), которая получена (1893) Е. Бамбергером при окислении диазобензола в щелочном растворе солью Гмелина или хамелеоном; лучшие выходы получаются, если окислению подвергается калиевая соль изодиазобензола (см. Нитрозоамины), которая, быть может, имеет строение C 6H5 N(NO)K. Эта кислота получена также действием азотного ангидрида на анилин в эфирном растворе при — 20°:
2C6H5.NH2 + N2O5 = 2C6H5.NH.NO2 + Н 2O.
Она кристаллизуется из нефтяного эфира в серебристо-белых листочках, темп. плавления 46 — 46,5°; около 100° разлагается со взрывом; в холодной воде довольно трудно растворима (окрашивает лакмус в красный цвет), в щелочах — легко; бариевая соль — (С 6 Н 5N.NO2)2 Ва.2Н 2 О. В присутствии минеральных кислот диазобензоловая кислота очень неустойчива, изомеризуется в нитроанилин H 2N.C6H4.NO2 (opтo- — гл. обр., частью пара-); в щелочных растворах, напротив, постоянна; C 6H5.N(NO2).K только при 230° — 290° распадается, при чем образуется анилин, KNO 3 и KNO 2. При восстановлении — Zn и С 2 Н 4O2 — получается диазобензол, действием амальгамы натрия получается изодиазобензол, а затем фенилгидразин —
C6H5.NH.NO2 → C6H5.NH.NO → C6H5.NH.NH2.
Действуя йодистым метилом на натриевую соль, получают метиловый эфеир кислоты, т. е. метилфенилнитроамин С 6H5.N(NO2)СН 3, темп. плавлеия 38,5 — 39,5°, который под влиянием кислот точно так же изомеризуется — в нитрометиланилин NO 2.C6H4.NH.CH3 (орто- и пара-), а при восстановлении дает фенилметилгидразин С 6 Н 5.(СН 3)N.NH2, как конечный продукт.
Что касается незамещенного амида азотной кислоты, называемого обыкновенно нитрамидом H2N.NO2, то он получен (1894, Тиле и Лахманом) из нитроуретана (NO2)HN.СО.OC 2H5, который раствором КОН в метиловом спирте был превращен в калиевую соль нитрокарбаминовой кислоты (NO 2)KN.СО.OK, а затем из этой соли была выделена серной кислотой со льдом сама нитрокарбаминовая кислота, которая тотчас же разложилась по уравнению:
(NO2)HN.СО.ОН = СО 2 + H2N.NO2.
Нитрамид осаждается из эфирного раствора лигроином в блестящих листочках с темп. плавл. 72°; легко растворим в воде, спирте, ацетоне, трудно — в бензоле; водный раствор обладает кислой реакцией, но прибавление щелочей ведет к разложению по уравн.:
H2N. NO2 = N2O + H2O
на закись азота и воду, которые составляют продукты разложения, и азотно-кисл. аммония NH 4.NO3. Нитрамид изомерен с азотноватистой кислотой и, по мнению Ганча, не содержит (NO 2)-группы. Ганч выражает эту изомерию следующими стереохимическими формулами:
С. С. Колотов. Δ .
|
Смотрии так же... |
|