Трихиноил
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| Т | ТА | ТВ | ТЕ | ТЁ | ТЗ | ТИ | ТК | ТЛ | ТМ | ТО | ТР | ТС | ТУ | ТХ | ТЦ | ТШ | ТЩ | ТЫ | ТЬ | ТЭ | ТЮ | ТЯ |
| ТРА |
| ТРД |
| ТРЕ |
| ТРЖ |
| ТРИ |
| ТРН |
| ТРО |
| ТРТ |
| ТРУ |
| ТРЫ |
| ТРЭ |
| ТРЮ |
| ТРЯ |
Трихиноил C6O6 + 8H2 O — представляет белый нерастворимый кристаллич. порошок, плавящийся при 95° с выделением углекислоты. Трихиноил интересен в теоретическом отношении потому, что он является продуктом полного окисления без разрыва связей гексаметиленного кольца и, получаясь из различных ароматических соединений, устанавливает тесную связь этих последних с производными гексаметилена или гексагидробензола. Постепенный переход этот от фенола C 6H5 OH к Трихиноил был доказан Ницким и Бенкизером в 1885 г. при изучении ими продукта конденсации металлического калия с окисью углерода, так наз. карбонилкалия (СОК) 6, представляющего калиевую соль гексаоксибензола. Вышеуказанная генетическая связь бензола с Трихиноил доказывается следующим рядом реакций получения этого последнего из фенола С 6H5 OH. При действии на водный раствор фенола бертолетовой солью и соляной кислотой получается хлоранил или тетрахлорхинон С 6 Сl 4 О 2; это вещество уже нужно рассматривать, как производное дигидробензола. При обработке азотисто-натриевой солью хлоранил переходит в нитраниловую кислоту C 6(NO2)2(OH)2O2, которая, в свою очередь, при восстановлении дает диамидотетраоксибензол C 6(NH2)2(OH)4, окисляющийся на воздухе в щелочном растворе в диамидодиоксихинон C6(NH2)2(OH)2O2. Это соединение при кипячения с соляной кислотой замещает свои амидогруппы (NH 2) гидроксилами (ОН) и переходит в тетраоксихинон С 6 (ОН) 4 О 2, легко уже окисляющийся азотной кислотой в Трихиноил Обратно, при осторожном восстановлении Трихиноил водным раствором сернистого газа можно получить диоксидихиноил или родицоновую кислоту С 6 (ОН) 2:О 2:О 2, которую можно рассматривать, как нестойкий в условиях образования Трихиноил промежуточный продукт между тетраоксихиноном и Трихиноил Резюмируя этот переход в нижеследующей схеме:
Фенол (оксибензол) C 6H5OH
Хинон (дикетодигидробензол) C 6H4O2
Тетраоксихинон C 6(OH)4O2
Родицоновая кислота (диокситетракетотетрагидробензол) С 6 (ОН) 2:О 2:О 2
Трихиноил (гексакетогексагидробензол)
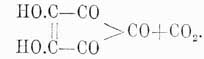
легко заметить, что бензольные производные, содержащие гидроксилы, особенно легко переходят в соединения кетогидробензольных рядов. Этот переход был давно известен для хинонов (см.), которые получаются легче всего из p-диоксибензолов, но он стоял совершенно особняком, и только Ницкий, в вышеупомянутой работе, показал его общность при получении и др. кетогидроароматических соединений. Трихиноил еще интересен и в другом отношении: по теории А. Байера наибольшей прочностью из возможных углеродистых колец должно обладать кольцо, состоящее из пяти атомов, и, следовательно, возможно было ожидать в соединениях, содержащих шестиатомное углеродистое кольцо, стремление перейти в соединения с пятиатомным кольцом. В действительности такие переходы известны, по все они совершаются или весьма длинным, непрямым путем, или при сравнительно высокой температуре, Трихиноил же при простом уже нагревании с водой до 90° теряет СО 2 и переходит в кроконовую кислоту:
Д. Χ. Δ.
|
Смотрии так же... |
|