Сульфоновые кислоты
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| С | СА | СБ | СВ | СГ | СД | СЕ | СЖ | СИ | СК | СЛ | СМ | СН | СО | СП | СР | СС | СТ | СУ | СФ | СХ | СЦ | СЧ | СЪ | СЫ | СЬ | СЭ | СЮ | СЯ |
| СУА |
| СУБ |
| СУВ |
| СУГ |
| СУД |
| СУЕ |
| СУЖ |
| СУЗ |
| СУИ |
| СУЙ |
| СУК |
| СУЛ |
| СУМ |
| СУН |
| СУО |
| СУП |
| СУР |
| СУС |
| СУТ |
| СУФ |
| СУХ |
| СУЧ |
| СУШ |
| СУЩ |
| СУЭ |
Сульфоновые кислоты или сульфокислоты (жирного ряда) — Сульфоновые кислоты кислотами называются производные серной кисл. OH—SO 2 —OH, получающиеся через замену одного из гидроксилов ее углеводородными остатками, напр. CH 8—SO2 —OH. Так происходят одноосновные Сульфоновые кислоты кислоты. При замещении двух гидроксилов в двух частицах серной кислоты двуатомным остатком или трех гидроксилов в трех частицах — трехатомным и т. д. будут образовываться Сульфоновые кислоты кислоты многоосновные, напр. CH 2(SO2—OH)2, СН(SО 2 —ОН) 3 и вообще С n Н m-x (SО 2 —ОН) x. По остаткам смотря, различают Сульфоновые кислоты кислоты с алкильными, алкогольными (спирто- или оксисульфокислоты), кетонными (сульфокетонокислоты) и кислотными остатками (сульфонкарбоновые кисл.).
Моносульфоновые кислоты CnH2n+1SO2 OH получаются при окислении (кипячением с азотною кислотою) меркаптанов C nH2n+1 SH, дитиоэфиров (C n Н 2n+1)2S2 и роданистых эфиров C nH2n+1 SCN. Окисление тиогликолей C nH2n(SH)2 и алкиленроданидов C nH2n(CSN)2 дает дисульфоновые кислоты. Другой способ получения есть действие галоидопроизводных углеводородов на сернистокислые соли. Здесь также можно получить одно-, дву- и трехсульфоновые кислоты, исходя из галоидопродуктов соответственного замещения. Так, действуя сернистокислым аммонием на CH 2ClCHCl2, получаем этантрисульфоновую кислоту SО 3 Н—СН 2 —СН(SО 3 Н) 2. Реакция галоидалкилов на сернистокислые соли употребляется преимущественно для получения моносульфоновых кислот. Сернисто-серебряная соль Аg 2 SО 3 дает при этом эфиры, напр.:
Ag2SO3 + 2C2H5J = C2H5SO2—O—C2H5 + 2AgJ
a калиевые соли дают прямо соли Сульфоновые кислоты кислот:
KSO3K + C2H5J = C2H5SO3K + KJ.
При действии на соли P 2Cl5 получаются хлорангидриды Сульфоновые кислоты кислот, представляющие масла, кипящие без разложения и трудно разлагаемые водой. Получение Сульфоновые кислоты кислот окислением меркаптанов и обратное получение меркаптанов из хлорангидридов Сульфоновые кислоты кислот показывает, что углеводородный остаток в них связан с серой. То, что при действии пятихлористого фосфора получаются хлорангидриды кислот RSO 2 Cl, показывает, что здесь имеется гидроксильная группа и, наконец, образование из сернистокислых солей доказывает, что гидроксил этот связан с серой, а не с углеводородным остатком. Эфиры этих кислот С n Н 2n+1 SО 2 ОС n Н 2n+1 изомерны с эфирами сернистой кислоты (C nH2n+1)O—SO—O(CnH2n+1). В первых один остаток CnH2n+1 связан с серой, а другой с кислородом, тогда как в последних оба остатка связаны с кислородом.
Метансульфоновая кислота СН 3 SО 3 Н — бесцветный сироп, разлагающийся выше 130°. Как и прочие Сульфоновые кислоты кислоты, она обладает сильными кислотными свойствами и образует много солей. Интересно получение этой кислоты синтетически (Колбе, 1845). При действии влажного хлора на сернистый углерод получается хлорангидрид трихлорметансульфоновой кислоты ССl 3 SО 2 Сl по уравнению:
CS2 + 5Сl 2 + 2Н 2 О = CCl 3SO2 Cl + 4НСl + SCl 2.
Этот хлорангидрид кристалличен, обладает пронзительным запахом, плавится при 135° и кипит при 170°. Вода разлагает его на трихлорметансульфоновую кислоту и HCl. Воcстанавливая полученную кислоту CCl 3SO3 H водородом, получают последовательно CHCl 2SO3H, CH2ClSO3 H и, наконец, метансульфоновую кислоту CH 3SO3 H. Хлорангидрид этой кислоты СН 3 SО 2 Сl получается при действии на нее пятихлористого фосфора. Это — жидкость, кипящая при 160°. Амид получается при пропускании аммиака в раствор хлорангидрида в абсолютном алкоголе и представляет длинные призматические кристаллы. Этансульфоновая кислота C2H5SO2 OH представляет расплывающуюся кристаллическую массу; очень постоянна. Этиловый эфир ее кипит при 213,4°. Остальные моносульфоновые кислоты С 3 Н 8 SО 3, С 4H10 SО 3 и т. д., подобно предыдущим, — сиропы или легко расплывающиеся кристаллы. В Сульфоновые кислоты кислотах кислород гидроксила может быть замещен серой; тогда получаются тиосульфоновые кислоты (см.).
Дисульфоновые кислоты получаются, кроме указанных выше способов, еще действием серного ангидрида на сульфонкарбоновые кислоты:
CH2(SO3H)CO2H + SO3 = СН 2 (SО 3 Н) 2 + СО 2.
Сильные двухосновные кислоты. Метандисульфоновая кислота СН 2 (SО 3 Н) 2 получается действием дымящейся серной кислоты на молочную при нагревании. Этандисульфоновая кислота С 2 Н 4 (SО 3H)2 представляет, подобно предыдущей, расплывающиеся кристаллы. Она легко растворима в алкоголе. Кристаллизуется с одной частицей воды и при 100° ее теряет. Метан- и этантрисульфоновые кислоты — легко расплывающиеся кристаллы.
Оксисульфоновые кислоты. Первичные алкоголи прямо соединяются с серным ангидридом, образуя оксисульфоновые кислоты:
СН 3 СH 2 ОН + SО 3 = СH 2 (SО 3 ОН)СН 2 ОН.
Кислые сернистокислые соли при действии на окиси и галоидгидрины гликолей дают соли оксисульфокислот, например:
Здесь также известны ди- и трисульфоновые кислоты. Изэтионовая кислота ОН—СН 2 —СН 2 SО 3 Н = С 2 Н 6 SО 4 получается при действии серного ангидрида на абсолютный алкоголь или эфир. При охлаждении до нуля и постоянном помешивании пропускают 15 частей SО 3 в 13 частей абсолютного эфира. Затем большой массой воды выделяют маслянистый слой диэтилсульфата, сушат его и снова обрабатывают серным ангидридом. Водный раствор полученного продукта кипятят, нейтрализуют баритом и кристаллизацией разделяют метионовокислый и изэтионовокислый барит. Изэтионовая кислота — сильно кислый сироп, образует соли и кристаллические соединения солей с другими веществами. Эфиры изэтионовой кислоты не перегоняются без разложения. Этионовая кислота OHSO2OCH2CH2SO3 H получается при действии SO 3 на абсолютный алкоголь или действием воды на хлорангидрид ее, который получается при действии этилена C 2H4 на хлорсульфоновую кислоту SO 3 HCl или на ангидрид, получаемый прямым соединением 2SО 3 с C 2H4. Соли ее постоянны, но сама кислота легко разлагается на изэтионовую кислоту и воду.
Сульфонкарбоновые кислоты легче всего получаются при действии SО 3 на органические кисл., напр.
SO3 + CH3COOH = SO3HCH2CO2H.
При этом серный ангидрид присоединяется к углеродному атому, стоящему рядом с карбоксилом. Можно вместо SO 3 действовать хлорсульфоновой кислотой или дымящейся серной. Если сульфонкарбоновые кислоты обрабатывать серным ангидридом при нагревании, то получаются дисульфоновые кислоты и выделяется угольная кислота (см. выше). Сульфонуксусная кислота C2H4SO5 + 1,5H2 O проще всего получается при нагревании уксусной кислоты с хлорсульфоновой до 140°. На воздухе она легко расплывается, плав. при 68—72° и представляет сильную двухосновную кислоту. С нею сходны сульфонпропионовая СН 3 СH(SО 2 H)СО 2 Н, сульфонмасляная СН 3 СН 2 СH(SО 3 H)СО 2 Н и др., представляющие сиропы. Стеариноксисульфоновая кисл. С 18 Н 36 SО 6 = ОНС 15 Н 30 СН 2 СH(SО 3 H)СО 2 Н получается при взбалтывании олеиновой кислоты (1 ч.) с одной частицей серной кислоты. Жидкость, легко растворимая в воде, алкоголе и эфире. Известны также производные ряда щавелевой кислоты, напр. сульфонянтарная кислота НSО 3 —С 2 Н 3 (CО 2H)2, получаемая вышеуказанными способами. Кристаллы ее весьма легко расплываются, при сплавлении с едким кали дают сернистый ангидрид и фумаровую кислоту.
В. Курбатов. Δ .
Ароматические С. кислоты. Сульфобензоловые кислоты — продукты действия серной кислоты или ее ангидрида на бензольные углеводороды:
С 6H6 + H2SO4 = С 6 Н 5 —SО 3 Н + H 2 О
или
С 6H6 + SО 3 = С 6 Н 5 —SО 3 Н.
По своему химическому характеру сульфобензоловые кисл. совершенно аналогичны Сульфоновые кислоты кислотам жирного ряда, но резко отличаются от этих последних по способам получения. В то время как реакция замещения водорода жирного углеводорода группой SО 3 Н совершается довольно трудно, ароматическиe соединения характеризуются тою легкостью, с какою они образуют Сульфоновые кислоты кислоты, в которых группа SО 3 Н замещает водород бензольного ядра. В большинстве случаев достаточно бывает кратковременного взбалтывания ароматического соединения с серным ангидридом на холоду или непродолжительного кипячения с дымящейся серной кислотой, чтобы образовалась моносульфокислота. Легкость образования Сульфоновые кислоты кислот в этом случае зависит от характера ароматического соединения. В случае углеводородов реакция протекает тем легче, чем беднее данный углеводород водородом (бензол дает Сульфоновые кислоты кислоты при кипячении с дымящейся серной кислотой, нафталин обрабатывают для получения моно-Сульфоновые кислоты кислоты обыкновенной крепкой Н 2 SО 4, при действии же дымящейся кислоты замещаются два водородных атома сульфогруппой и образуются ди-Сульфоновые кислоты кислоты). Реакция облегчается также введением в ядро амидо- и оксигрупп и сильно затрудняется присутствием очень отрицательных групп, напр. карбоксильных. Однако, вообще говоря, употребляя серную кислоту с большим или меньшим содержанием серного ангидрида всегда на холоду можно получить моно-Сульфоновые кислоты кисл., при кипячении — ди-Сульфоновые кислоты, а при сильном нагревании в запаянных трубках — три-Сульфоновые кислоты Больше трех водородов в бензольном ядре до сих пор не удалось заместить сульфогруппами. Кроме непосредственной обработки ароматических соединений серной кислотой, заслуживает внимания еще один случай образования сульфобензол. кисл., именно при действии сернистого газа на водный раствор солей диазосоединений:
C6H5—N2Cl + H2O + SO2 = C6H5SO3H + N2 + HCl.
Полученные тем или др. способом сульфобензоловые кисл. представляют очень прочные кристаллические тела, которые при сухой перегонке выделяют серный ангидрид и переходят в ароматические производные, не содержащие сульфогруппы:
С 6 Н 5 —SО 3 Н = C 6H6 + SO3.
При сплавлении с едким кали сульфобензоловые кисл. замещают сульфогруппу гидроксилом и дают фенолы, а при сплавлении их щелочных солей с цианистым калием образуются нитрилы:
C6H5—SO3 K + КСN = С 6 Н 5 —СN + К 2 SО 3.
В технике многие сульфобензоловые кислоты имеют громадное значение при получении красок. Сульфобензоловая или бензолсульфоновая кисл. C6H5SO3 H, получающаяся продолжительным кипячением бензола с крепкой серной кислотой, представляет нежные иголочки, плавящиеся при 50—51° и расплывающиеся на воздухе. Она легко растворима в воде и спирте, очень трудно в бензоле и совсем не растворима в эфире. В последнее время ею с успехом стали заменять обыкновенную серную кислоту при фабричном способе получения обыкновенного эфира, образование которого в этом случае идет по след. уравнениям:
C6H5SO3 H + С 2 Н 5 ОН = C6H5SO3C2H5 + Н 2 О
C6H5 SО 3 С 2 Н 5 + С 2H5 ОН = С 2 Н 5 ОС 2 Н 5 + C6H5—SO3H.
След., здесь, как и в случае серной кислоты, теоретически неограниченно большое количество спирта можно переработать в эфир данным количеством сульфобензоловой кисл. При старом способе всегда происходили побочные реакции, расходующие значительные количества серной кислоты. Если же обрабатывать спирт сульфобензоловой кисл., то этих побочных реакций почти не наблюдается, в силу чего расход кислоты ничтожен и, след., производство становится более выгодным.
При действии серной кислоты на ароматические амины реакция совершается очень бурно, и ее часто приходится умерять, или беря вместо серной кислоты этилсерную кислоту C 2H5SO4 H, или же вместо амина кислотные анилины. Простейшим представителем сульфоанилиновых кислот является сульфаниловая кислота, получающаяся нагреванием этилсернокисл. анилина:
C2H5SO4H—NH2C6H3 = NH2C6H4SO3H + C2H5OH.
При этой реакции сульфогруппа становится в параположение (см.) к амидогруппе. Сульфаниловая кислота кристаллизуется с 2H 2 O в моноклиноэдрических кристаллах, а из дымящейся соляной кислоты выпадает в безводном состоянии. При 280—300° она, не плавясь, обугливается. В технике она употребляется для получения различных парасульфопроизводных бензола, для чего ее предварительно переводят в диазосоединение и затем пользуются способностью диазотел с легкостью обменивать свою диазогруппу на различные радикалы.
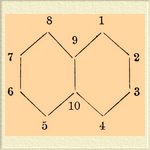
При действии серной кислоты на нафталин, нафтолы и нафтиламины получаются различные сульфокислоты, играющие весьма важную роль при получении красящих веществ. Если мы обозначим цифрами углеродные атомы нафталина следующим образом
то наиболее важные из сульфонафталиновых кислот будут следующие: нафтиоловая или 1,4-нафтиламинсульфокислота C 10H6(NH2)SO3 H, которая преимущественно употребляется для получения красной краски конго. Из β-нафтиламина получают F или о-нафтиламинсульфокислоту-2,7, идущую на приготовление бензидиновых тетразокрасок. При растворении β-нафтола в концентрированной кислоте получаются две нафтолсульфокислоты; из них имеющая строение, вероятно, -2,6 называется шефферовской сульфокислотой, а со строением -2,5 или -2,8 — носит название байеровской, или кроцеинкислоты, идет на приготовление кроцеиншарлаха. Из дисульфо-β-нафтоловых кислот употребительны в технике две R и G -кислоты, из которых G дает особенно ценные красные краски; так, при конденсации ее с паранитродиазобензолом получается краска, по прочности и красоте оттенка с успехом конкурирующая с ализарином. Сульфоантраценовые производные — см. Оксиантрахиноны. Рядом с описанными Сульфоновые кислоты кислотами нужно поставить сульфопиридиновые и сульфохинолиновые кислоты, которые, как по способам получения, так и по свойствам вполне аналогичны сульфобензоловым кисл.
Д. А. Хардин. Δ .
|
Смотрии так же... |
|