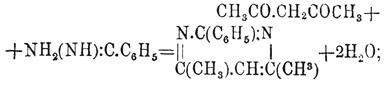Пиримидины
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| П | ПЕ | ПА | ПЕ | ПЁ | ПЖ | ПИ | ПЛ | ПН | ПО | ПП | ПР | ПС | ПТ | ПУ | ПФ | ПХ | ПЧ | ПШ | ПЫ | ПЬ | ПЭ | ПЮ | ПЯ |
| ПИА |
| ПИБ |
| ПИВ |
| ПИГ |
| ПИД |
| ПИЕ |
| ПИЖ |
| ПИЗ |
| ПИИ |
| ПИЙ |
| ПИК |
| ПИЛ |
| ПИМ |
| ПИН |
| ПИО |
| ПИП |
| ПИР |
| ПИС |
| ПИТ |
| ПИУ |
| ПИФ |
| ПИХ |
| ПИЦ |
| ПИЧ |
| ПИШ |
| ПИЩ |
| ПИЭ |
| ПИЯ |
Пиримидины или метадиазины, подобно пиразинам (см.) и пиридазинам (см.), имеют замкнутую группировку, из 4 атомов углерода и 2 ат. азота, но находящихся друг к другу в мета-положении. По своему химическому характеру Пиримидины представляют слабые основания и могут быть рассматриваемы как циклические амидины. Для определения мест боковых цепей атомы углерода в Пиримидины обозначаются греческими буквами в след. порядке 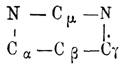 . Этот класс соединений сравнительно мало разработан, и только некоторые из его представителей имеют интерес или как продукты конденсации жирных нитрилов, или же как вещества, принадлежащие к группе мочевой кислоты. Получаются Пиримидины конденсацией β-дикетонов с амидинами:
. Этот класс соединений сравнительно мало разработан, и только некоторые из его представителей имеют интерес или как продукты конденсации жирных нитрилов, или же как вещества, принадлежащие к группе мочевой кислоты. Получаются Пиримидины конденсацией β-дикетонов с амидинами:
Этой реакцией возможно получать и некоторые производные Пиримидины; так, из амидина и бромистого триметилена получаются тетрагидро-Пиримидины:
NH2(NH) = C—C6H5 + Br—СН 2 —СН 2 —СН 2 Вr = С 6 Н 5 С = (N—NH) = (СН 2)2 = СН 2 + 2НВr;
с эфирами кетокислот образуются окси-Пиримидины, с эфирами β-кетодикарбоновых кислот — эфиры оксипиримидинкарбоновых кислот. При этих реакциях интересно то, что группа NH не реагирует с СО 2 Н, как обыкновенно, т. е. давая (—CO—N=), а в реакцию вступает NH и (—СН 2 —СО 2 H) и образуется группировка (—CH=C(OH)—N=). Второй способ получения Пиримидины, вполне не разъясненный, состоит в конденсации жирных нитрилов в присутствии металлического натрия при 150°. При этом три молекулы нитрила образуют α-амидо-Пиримидины, или таналкин, который азотисто-натриевой солью легко переводится в α-окси-Пиримидины: 3CH 3—CN = μ, γ (CH3)2C4HN2(NH) α. Вероятно, здесь сначала образуется динитрил типа R—C(NH)—CHR—CN; возможно, что в реакции участвует и более 3 мол. нитрила, так как всегда при этом получается NaCN. Как на пример Пиримидины можно указать на кианкониин, или α, μ-диэтил-β-метилпиримидин С 4 НN 2 (С 2 Н 5)2 (СН 3), масло, кипящее при 205°, по запаху и по своему физиологическому действию напоминающее алкалоид кониин. Кетопроизводные гидропиримидинов известны под названием урацилпроизводных и находятся в тесной связи с мочевой кислотой (см.). Бензопроизводные Пиримидины — см. Хиназолины.
Д. А. Хардин. Δ .
|
Смотрии так же... |
|