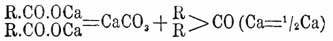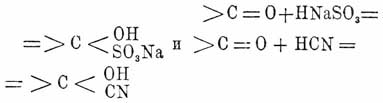Кетоны
Энциклопедия Брокгауза Ф.А. и Ефрона И.А. (1890 - 1916гг.) Статьи для написания рефератов, курсовых работ, научные статьи, биографии (118447 статей и 6000 рисунков).
|
|
| А | Б | В | Г | Д | Е | Ё | Ж | З | И | Й | К | Л | М | Н | О | П | Р | С | Т | У | Ф | Х | Ц | Ч | Ш | Щ | Ы | Э | Ю | Я | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | Z |
| К | КЫ | КА | КВ | КГ | КЕ | КЁ | КИ | КЛ | КМ | КН | КО | КР | КС | КТ | КУ | КХ | КШ | КЫ | КЬ | КЭ | КЮ | КЯ |
| КЕБ |
| КЕВ |
| КЕГ |
| КЕД |
| КЕЖ |
| КЕЗ |
| КЕИ |
| КЕЙ |
| КЕК |
| КЕЛ |
| КЕМ |
| КЕН |
| КЕО |
| КЕП |
| КЕР |
| КЕС |
| КЕТ |
| КЕУ |
| КЕФ |
| КЕХ |
| КЕЦ |
| КЕЧ |
| КЕШ |
| КЕЯ |
Кетоны — класс органических соединений, характеризующийся присутствием одной или нескольких двухэквивалентных карбонильных групп CO, по числу которых отличают моно-, ди- и т. д. Кетоны В монокетонах отличают Кетоны с двумя одноэквивалентными предельными и непредельными переменными, общей формулы R'CO"R' (R — углеводородный остаток) и Кетоны с одной двухэквивалентной переменной: R"СО". Если переменные R в монокетонах формулы RCOR одинаковы, получаются простые Кетоны, а если переменные R различны — будут смешанные Кетоны Предельные Кетоны выражаются общей формулой С nH2n+1.CO.CnH2n+1 и представляют гомологический ряд, распадающийся на многочисленные порядки изомерных Кетоны Изомерия начинается с Кетоны С 5 и обуславливается различием числа углеродных атомов в отдельных переменных или при равенстве числа углеродных атомов изомерией углеводородного остатка. Называют жирные Кетоны, обыкновенно обозначая оба углеводородных остатка, связанных с карбонилом, и прибавляя слово Кетоны, например СН 3 СОСН 3 называется диметилкетон, СН 3 СОС 2 Н 5 — метилэтилкетон и т. п. Их можно представить также происшедшими от соединения кислотного остатка с углеводородным и называть согласно с этим: СН 3 СОСН 3 метилацетилом, СН 3 СОС 5 Н 5 этилацетилом или метилпропионилом и т. п. Исходят также и из углеводородов: кетобутан СН 3 СОС 2 Н 5, кетопропан CH 3COCH3 и т. д. (Байер). Наконец, простые Кетоны получают название от тех кислот, от которых произошли, с окончанием — "он": (СН 3)2 СО — ацетон; (С 2 Н 5)2 CО — пропион, (С 3 Н 7)2 СО — бутирон и т. д. Номенклатура ароматических кетонов составляется также различно: С 6 Н 5 СОС 6 Н 5 — дифенилкетон или бензофенон, СН 3 СОС 6 Н 5 — метилфенилкетон или ацетофенон, или ацетилбензол и т. д.
Общие способы образования кетонов. Кетоны могут быть получены из всех классов органических соединений, за исключением альдегидов. 1) Из углеводородов. При нагревании с водой дигалоидозамещенных углеводородов, в которых оба атома галоида находятся при одном атоме углерода и насыщают его, происходит Кетоны:
(СН 3)2 ССl 2 + Н 2 О = (СН 3)2 СО + 2НСl;
С 6 Н 5 ССl 2 С 6 Н 5 + Н 2 О = 2НСl + С 6 Н 5 СОС 6 Н 5.
Галоидопроизводные углеводородов этиленного ряда, содержащие CCl или CBr, в этиленном остатке при действии слабой серной кислоты или окиси свинца и воды дают Кетоны:
СН 3 ССl:СН 2 + H2 O = (СН 3)2 СО + НСl.
Присоединением воды к углеводородам формы RC≡CH под влиянием, например, бромной ртути (Кучеров) происходят Кетоны: СН 3 С:СН+Н 2 О=СН 3 СОСН 3. Окислением ароматических углеводородов ряда дифенилметана также получаются ароматические Кетоны:
С 6 Н 5 СН 2 СН 3 + О 2 = С 6 Н 5 СОСН 3 (метилфенилкетон) + Н 2 О.
Углеводороды С n Н 2n—2 при нагревании с уксусной кислотой до 280° дают продукты присоединения, из которых действием воды получают Кетоны (B é hal, Desgrez). Эти реакции не имеют практического значения, но важны для изучения изомерии Кетоны 2) Из спиртов. При окислении первичных спиртов формулы RCHR 1.CH2 OH происходит муравьиная кислота и Кетоны — RCOR 1, например:
СН 3 СН(С 2 Н 5)СН 2 ОН + О = СН 3 СОС 2 Н 5 + СН 2 О 2 + Н 2 О.
При окислении вторичных спиртов (окисление по возможности слабое) получается:
(CnH2n+1)2CH(OH) + O = (Cn2n+1)2 CO + Н 2 О
например СН 3 СН(ОН)СН 3 + О = СН 3 СОСН 3 + Н 2 О.
Третичные спирты R:C(OH)R 1 превращаются в Кетоны в момент образования. Вторичные и вторично-третичные гликоли C nH2n(OH)2 при обработке водоотнимающими веществами дают Кетоны Третичные гликоли (пинаконы) разлагаются на Кетоны и воду уже при нагревании со слабой серной кислотой:
(СН 3)2 С(ОН)(ОН)С(СН 3)2 (пинакон) = Н 2 О + (СН 3)3 С.СО.СН 3 (третичный метилбутилкетон).
3) Из кислот Кетоны получаются сухой перегонкой солей (лучше всего Ca или Ba) одноосновных жирных или ароматических кислот; причем, если была взята соль одной кислоты, получается простой Кетоны, при перегонке же эквивалентной смеси солей различных кислот получается смешанный Кетоны При этой реакции металл выделяется в виде углекислой соли, а радикалы R двух кислотных молекул соединяются с карбонилом:
например (СН 3 СОО) 2 Са = (СН 3)2 СО + СаСО 3
(СН 3 СОО) 2 Са + (С 2H5 СОО) 2 Са = 2СаСО 3 + 2СН 3 СОС 2 Н 5
(СН 3 СО 2)2 Са + (С 6 Н 5 СО 2)2 Са = 2СаСО 3 + 2СН 3 СОС 6 Н 5.
При перегонке солей всегда происходят побочные продукты: из уксуснокислого кальция, например, помимо C 6H6 O, получены еще гомологи C 4H8 O (t° кипения 65°), С 5H10 О (t° кипения 90—95°) и думазин С 5H10 О (Fittig). Реакция довольно обща: с ее помощью получены наиболее сложные Кетоны (обобщена она Шанселем). На отношении известковых солей к нагреванию Destrem основал способ получения Кетоны сухой перегонкой известковых соединений первичных спиртов: (С 2 Н 5 О) 2 Са=С 3 Н 6 О+СаО+СН 4, потому что (С 2 Н 5 О) 2 Са=2С 2 Н 4 +СаО+Н 2 О и (С 2 Н 5 О) 2 Са+2Н 2 О=Са(С 2 Н 3 О 2)+H8. Кетоны можно получать также нагреванием до 190° натровых солей кислот С n Н 2n О 2 с соответствующим ангидридом (при ангидриде другой кислоты получается смешанный Кетоны):
CH3 COONa + (СН 3 СО) 2 О = CH 3 C(ONa)(ОСОСН 3)2 = (СН 3)2 СО + СО 2 + СН 3 СО 2 Nа (Перкин).
Другая общая реакция получения Кетоны состоит в действии цинкорганических соединений на хлорангидриды одноосновных кислот жирного и ароматического ряда (Киоцца и Фрейнд). В первый момент реакции происходит присоединение хлорангидрида к цинкорганическому соединению: СН 3 СОСl+Zn(СН 3)2 =СН 3 С(СН 3)СlOZnСН 3 и затем уже обмен хлора на углеводородный остаток. Действуя в первый момент водой или новой частицей хлорангидрида, получают Кетоны (во вторую фазу с водой происходят третичные спирты):
СН 3 С(СН 3)СlOZnСН 3 + Н 2 О = (СН 3)2 СО + HCl + ZnО + CH 4
поэтому обыкновенно и берут две частицы хлорангидрида на частицу цинкорганического соединения:
2С 6H5 СОСl + Zn(СН 3)2 = ZnCl2 + 2С 6 Н 5 СОСН 3 (ацетофенон).
Вместо хлорангидрида можно взять ангидрид и вместо цинкорганического соединения цинк-натрий и йодгидрин (Зайцев):
(СН 3 СО) 2 О + (CH 3I)2 + Na2 Zn = 2(СН 3)2 СО + 2NaI + ZnO.
Ароматические Кетоны получаются также действием хлорангидридов кислот на ароматические углеводороды в присутствии хлористого алюминия: C 6H5COCl+C6H6=(C6H5)2 CO+HCl, тот же результат получается при замене хлорангидрида хлорокисью углерода (Фридель и Крафтс). Кислоты С n Н 2n O с большим частичным весом при нагревании с фосфорным ангидридом дают Кетоны (Киппинг): 2C 6H13CO2 H=(С 6H13)2 СО+СО 2 +Н 2 О. β-кетонокислоты (см.) и особенно их эфиры разлагаются при кипячении со слабыми щелочами или кислотами на спирт, СО 2 и Кетоны:
CH.CO.CH2CO2C2H5 + Н 2 О = С 2 Н 5 ОН + СО 2 + СН 3 СО.СН 3.
Так как атомы водорода в группе СН 2 ацетоуксусного эфира можно обменять на любой углеводородный остаток, то появляется возможность синтеза Кетоны общей формуле СН 3 СОСН 2(CnH2n+1) и СН 3 СО.СН(С n Н 2n+1)2 (Франкланд и Дюппа). На отщеплении кетонокислот основан также способ получения Кетоны из хлорангидридов C nH2n—1 OCl нагреванием с хлорным железом, причем выделяется НСl и получается соединение кетонокислоты с хлорным железом, которое водой разлагается, и кетонокислота, выделяя СО 2, дает Кетоны:
2С 2 Н 5 СОСl + FеСl 3 = С 2 Н 5 СОС 2 Н 4 СОСl 2 FеСl 2 + НСl
и C 2H5COC2H4COCl2.FeCl2 + H2 O = С 2 Н 5 СОС 2 Н 5 + СО 2 + FeCl3 + НСl.
Кетоны получаются также при окислении третичных оксикислот С n Н 2n О 3:
(С 3 Н 7)2 С(ОН)СО 2 Н + О = (С 3 Н 7)2 СО + СО 2 + Н 2 О.
Щелочные соли β-галоидопроизводных α-оксикислот (со вторичным углеводородным остатком) при кипячении с водой дают Кетоны:
СН 2 Сl.СН 3 С(ОН)СО 2 Nа = (СН 3)2 СО + NaCl + СО 2.
Кетоны (предельные и непредельные), наконец, можно получать нагреванием в токе окиси углерода алкоголятов натрия в присутствии солей.
Свойства. Кетоны показывают нейтральную реакцию; низшие члены их — легкоподвижные жидкости с характерным запахом, перегоняющиеся без разложения и растворимые в воде. С увеличением содержания углерода способность растворяться в воде быстро падает; средние и высшие члены в воде уже нерастворимы, но хорошо растворяются в спирте и эфире. Высшие члены (от С 13 Н 26 О) тела твердые кристаллические, не перегоняющиеся под обыкновенным давлением. Все вообще Кетоны легче воды. Ароматические Кетоны в большинстве жидкости. Кетоны изомерны альдегидам (см.) и имеют много свойств общих с ними (Кетоны можно рассматривать как альдегиды, в которых атом водорода замещен углеводородным остатком). При восстановлении Кетоны двойная связь кислорода с углеродом в группе >С=О переходит в простую, и из этой группы с присоединением водорода получается группа — 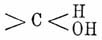 , при этом Кетоны переходят во вторичные спирты: RCOR 1 переходит в RCH(OH)R 1, например ацетон во вторичный пропиловый спирт:
, при этом Кетоны переходят во вторичные спирты: RCOR 1 переходит в RCH(OH)R 1, например ацетон во вторичный пропиловый спирт:
СН 3 СОСН 3 + 2Н = СН 3 СН(ОН)СН 3.
При восстановлении натрием в присутствии воды образуются наряду с вторичными спиртами третичные гликоли (пинаконы) — соединения, происшедшие из двух частиц Кетоны, например:
2(СН 3)2 СО + 2Н = (СН 3)2.С(ОН)С(ОН)(СН 3)2.
Соединения Кетоны с кислыми сернистокислыми щелочами и синильной кислотой также происходят с превращением двойной связи в группе СО в простую:
Соединения с кислыми сернистокислыми щелочами особенно характерны для жирных Кетоны и употребляются для их очищения и отделения. Соединения эти образуются при взбалтывании Кетоны с концентрированным раствором кислой сернистокислой щелочи. При нагревании со слабыми кислотами или углекислыми щелочами снова выделяется Кетоны Соединения эти образуются, впрочем, не со всеми Кетоны, а только с теми, которые содержат метильную группу (Гримм). С HCN кетоны дают нитрилы оксикислот:
(СН 3)2 СО + HCN = (СН 3)2 С.(OH)CN.
Под влиянием НСl (газ) на смесь Кетоны и меркаптанов происходит их соединение с выделением воды и образованием меркаптолов (Бауман), например:
СН 3 СОСН 3 + 2С 2 Н 5 SН = (СH 3)2 С.(SC 2H5)2 + Н 2 О.
Меркаптолы нелетучи, нерастворимы в воде и очень прочны относительно действия щелочей и кислот. Пятихлористый фосфор переводит Кетоны в хлоропроизводные углеводородов, замещая кислород карбонильной группы двумя атомами хлора:
(СН 3)2 СО + PCl 5 = (СН 3)2 ССl 2 + PCl3;
реакция легко идет дальше и атом хлора с водородом соседнего атома углерода выделяется в виде НСl, таким образом происходят непредельный хлоропроизводные: (СН 3)2.С.Сl 2 -НСl=СН 3.СН 2.С.Cl. Для карбонильных соединений особенно характерен переход в соединения, в которых кислород заменен двухэквивалентным, содержащим азот остатком. Такие соединения с выделением воды получаются при смещении Кетоны с водным раствором гидроксиламина (ацетоксимы — кетоксимы):
>С = О + H 2 NOH = >С = NOH + Н 2 О
и действием гидразинов, особенно фенилгидразина (гидразоны):
>C = O + H2NOH = >C = NOH + H2 O и
>С = О + Н 2 NNНС 6 Н 5 = >С = NNHC 6H5 + H2O.
Кетоксимы в большинстве тела твердые кристаллические, низший член их перегоняется без разложения и растворим в воде. При нагревании с кислотами происходит распадение на гидроксиламин и Кетоны Амальгама натрия восстанавливает кетоксимы в кислом растворе до первичных аминов:
(CH3)2CNOH + 4H = (CH3)2CHNH2 + H2O.
Гидроксильный водород кетоксимов может быть замещен натрием, спиртовым или кислотным остатком. Замечательное превращение претерпевают ацетильные производные кетоксимов с третичным атомом водорода при нагревании: диизопропилацетоксим, например, посредством интермолекулярной перестановки атомов переходит в изомасляный изопропиламид:
(СН 3)2 СНС(NOН)СН(СН 3)2 = (CH3)2CHCONHCH(CH3)2.
То же происходит и при ароматических кетоксимах: дифенилацетоксим, например, под влиянием PCl 5 вместо (С 6 Н 5)2 С.NCl дает изомерный хлористый бензанилид C 6H5CClNC6H5. Гидразоны перегоняются без разложения в вакууме, постоянны относительно щелочей, но кислотами разлагаются опять на Кетоны и гидразины. Очень характерны фенилгидразинные производные: они служат даже для количественного определения Кетоны
От альдегидов Кетоны резко отличаются своим отношением к окислителям: слабые окислители на них не действуют (Кетоны не восстановляют окиси серебра), да и более сильные действуют медленно и чем больше молекулярный вес Кетоны, тем труднее окисление (Hercz). Лучше изучено и легче идет окисление с хромовой смесью (3 части K 2Cr2O7, 1 часть Н 2 SО 4 и 10 частей H 2 О), причем Кетоны распадаются на кислоты с меньшим содержанием углерода, чем во взятом Кетоны, и распадение происходит всегда между карбонилом и соседним атомом углерода, так что одна переменная окисляется с карбонилом, а другая — самостоятельно. Ацетон, например, СН 3 СОСН 3 окисляется в уксусную кислоту СН 3 СООН и углекислоту СО 2 (продукт дальнейшего окисления муравьиной кислоты); диэтилкетон — СН 3 СН 2 СОCН 2 СН 3 в пропионовую кислоту СН 3 СН 2 СООН и уксусную кислоту СН 3 СООН. В случае смешанных Кетоны окисление может идти по двум направлениям, так как каждая переменная может окисляться с карбонилом и в результате будет 4 кислоты, так, например, этилизобутилкетон СН 3 СН 2 СОСН 2 СН(СН 3)2, с одной стороны, может дать пропионовую кислоту СН 3 СН 2 СООН и изомасляную кислоту СН(СН 3)2 СООН, а с другой стороны — уксусную СН 3 СООН и изовалериановую (СН 3)2 СНСН 2 СООН. Которая из этих реакций главная и которая побочная — зависит от природы переменных и от условий окисления. Раньше полагали возможным вывести правило, что карбонильная группа окисляется вместе с наименее гидрогенизированным углеводородным остатком (Попов), но дальнейшие исследования доказали, что все зависит от природы переменных. Так как метил СН 3 и фенил C 6H5 особенно трудно окисляются, то в Кетоны, их содержащих, они при окислении остаются соединенными с карбонилом. Вторичный радикал RСН окисляется легче, чем первичный RСН 2. В большинстве — чем богаче радикал углеродом, тем он труднее окисляется (Вагнер). Щелочным раствором марганцово-калиевой соли можно иногда окислить Кетоны до кетонокислот с равным содержанием углерода (Gl ü cksmann), стало быть, без разрыва углеродной цепи. Так, например, из пинаколина (СН 3)3 С.СОСН 3 происходит триметилпировиноградная кислота (СН 3)3 С.СО.СООН. В ароматическом ряду это происходит иногда почти количественно. Разрыв углеродной цепи происходит также под влиянием крепкой азотной кислоты, причем происходят динитропроизводные углеводородов; например, пропион С 2 Н 5 СОС 2 Н 5 дает динитроэтан CH 3CH(NO2)2, метилпропилкетон СН 3 СОС 3 Н 7 — динитропропан СН 3 СН 2 СН(NO 2)2 (Шансель). Аммиак не дает с Кетоны продуктов аналогичных альдегидаммиакам, но образует кислородные основания (изучены Гейнцом), с ацетоном, например, дает диацетонамин C 6H13 NO и триацетонамин C 9H17 NO, которые представляют собственно продукты уплотнения ацетона. Водород в жирных переменных Кетоны может быть замещен галоидами, цианом, роданом, гидроксилом, изонитрозогруппой и группой НSО 3, в ароматических — галоидами, нитрогруппой, амидом, гидроксилом и HSO 3. Многочисленные галоидопроизводные Кетоны образуются прямым действием галоидов на Кетоны Действием соляной кислоты на динитрилы получаются циановые производные Кетоны:
CH3C(NH)CH2 CN + Н 2 О = CH 3COCH2CN + NH3.
Образование изонитрозокетонов, помимо способа, указанного при кетоальдегидах (см.), происходит еще под влиянием азотистой кислоты и едкого кали в избытке на гомологи ацетоуксусного эфира:
СН 3.СО.СН(СН 3).СО 2.С 2 Н 5 + HNO2 = CН 3COC(NOH)CH3 + С 2 Н 5 ОН + СО 2 (см. Изонитрозосоединения).
Непредельные жирные Кетоны бедны числом и малоизвестны. Они прямо соединяются с галоидами, галоидоводородными кислотами и водородом, некоторые также и с аммиаком. Непредельные Кетоны общей формулы С n Н 2n—2 O не получаются из кислот С n Н 2n—2 O, но происходят при разложении кислот С 2 Н 2n—4O3, главным образом из предельных Кетоны действием щелочей и кислот, причем выделяется вода и получается непредельный Кетоны, который является в то же время продуктом уплотнения (Кетоны жирные и ароматические склонны вообще к реакциям уплотнения, но не дают полимеров, как альдегиды). Действуя, например, на ацетон серной кислотой (Капе), известью (Фиттиг), цинкорганическими соединениями (Павлов) или, чаще, насыщая его хлористым водородом и обрабатывая спиртовым KHO получают окись мезитила (изопропилиденацетон):
СО.(СН 3)2 + СО.(СН 3)2 — Н 2 О = (СН 3)2.С.СН.СО.СН 3.
Диацетоновый спирт при обработке купоросным маслом (Гейнц) дает также окись мезитила:
СН 3 СОСН 2.С(СН 3)2 ОН = (СН 3)2.С.СН.СО.СН 3 + Н 2 О.
Окись мезитила получается еще и при многих других реакциях. Дальнейшей конденсацией ацетона известью (Фиттиг) или соляной кислотой и спиртовым KHO (Baeyer) получается форон (СН 3)2.С.СН.СО.СН.С(СН 3)2 (диизопропилиденацетон), происходящий из трех частиц ацетона с выделением двух частиц воды. Оба эти соединения дают оксимы, пятихлористый фосфор замещает кислород обоих двумя атомами хлора, оба дают продукты присоединения с бромом и т. д., что доказывает принадлежность их к Кетоны и непредельность их. Дальнейшим уплотнением ацетона получается ксилитон C 12H18 O и возможно уплотнение еще дальше. Нахождение Кетоны в природе и их практическое применение незначительны. В технике имеет значение один только ацетон (см.).
Ф. Ворожейкин. Δ .
|
Смотрии так же... |
|