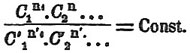|
Иллюстрация к статье на тему "Химические равновесия". Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
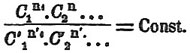
Химические равновесия - — Явления химического равновесия охватывают область неполных превращений, т. е. таких случаев, когда химическое превращение материальной системы совершается не до конца, но прекращается после того, как изменению подвергнется часть вещества. В подобных случаях конечным результатом химической реакции является не исчезновение взятых тел и образование новых (одного или нескольких), ранее в системе не заключавшихся, а достижение такого состояния системы, при котором одновременно и совместно существуют и исходные, и образовавшиеся при реакции тела, не испытывая уже дальнейшего превращения. При определенных условиях, такое состояние устанавливается тогда, когда между количествами исходных и полученных тел будет достигнуто определенное отношение, когда будет, как говорят, достигнут предел, и раз этот предел будет достигнут, система способна существовать, не изменяясь, бесконечное время, хотя и будет заключать в себе тела, способные при другом количественном отношении испытывать превращение. Таким образом, в таких системах тела, способные испытывать превращения, остаются без изменения в состоянии равновесия. Общей причиной существования такого равновесия является то обстоятельство, что при одних и тех условиях температуры и давления, химическое превращение может совершаться в двух противоположных направлениях, другими словами, оно обратимо. Система А превращается в систему В, но при этих же условиях и система В превращается в систему А. Очевидно, что ни одно и ни другое превращение не могут совершиться сполна, но должна получиться система, заключающая и А, и B, должно установиться некоторое среднее положение, при котором тела А и В будут находиться в равновесии. Характерным свойством такого химического равновесия будет то, что оно является равновесием устойчивым, так как всякое отклонение от состояния равновесия непременно вызовет в системе реакцию, которая приведет систему к прежнему состоянию равновесия. Оно также будет подвижным равновесием, так как изменение условий равновесия вызовет в системе такие превращения, которые приведут систему к новому состоянию равновесия, тоже устойчивого. Общие законы и характер химических равновесий изложены в статьях Правило фаз и Обратимость химических реакций (см.), здесь же мы познакомимся с количественной стороной вопроса и с приложением термодинамики для решения вопроса о том, как изменяется химическое превращение под влиянием различных условий. При всех химических превращениях состояние равновесия обуславливается тремя величинами: количествами действующих тел, или их массами, температурой и давлением. Самый характер равновесия может быть, в зависимости от числа действующих тел и от числа фаз, троякого рода: или возможно только одно состояние равновесия при совершенно определенных температуре и давлении, или равновесие возможно при различных температурах, причем при каждой температуре возможно только одно состояние равновесия, или, наконец, при каждой температуре существует бесчисленное множество состояний равновесия. Какое из этих трех равновесий приложимо в каждом данном случае — это определяется правилом фаз. Наша задача заключается в том, чтобы определить, как будет изменяться состояние равновесия, т. е. предел реакции, в зависимости от изменения трех переменных: массы действующих тел, температуры и давления.
|