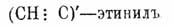|
Иллюстрация к статье на тему "Химическая номенклатура". Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
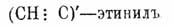
Химическая номенклатура - — страдает беспринципностью и синонимизмом, благодаря чему она трудна для изучения (ср. отзыв о ней Дюма — Орто). Древние называли различные вещества частью по их происхождению, частью по месторождению, частью же употребляли для них случайные названия. Точно так же поступали европейские алхимики ХIII в., которые для известных тел употребляли старые, принятые раньше имена, а для новых изобретали названия, характеризовавшие иногда какое-нибудь выдающееся качество данного тела; напр., спирт был ими назван. — aqua ardens. Их попытки обобщения номенклатуры были очень неудачны, как видно из того, что слово mercurius было приложено ко многим летучим жидкостям, и ртуть называлась mercurius communis, а тот же спирт — mercurius vegetabilis; еще большую путаницу вызывало стремление к картинности названий; так, напр., нашатырь обозначался синонимами: anima sensibilis, cancer, aquila [Aquila alba называлась впоследствии однохлористая ртуть, каломель — Hg 2Cl2 (Kopp, "Geschichte der Сb", 1, 1847, 1327) . ], lapis aquilinis, lapis angeli conjugentis, aqua duorum fratrum ex sorore, причем каждый писатель старался употребить свое собственное название. С течением времени и с накоплением фактических сведений почувствовалась, однако, потребность в упрощении X. номенклатуры, и она сказалась в появлении общих названий; так, все растворимые в воде вещества, обладающие вкусом, начали обозначать словом Sal (sal tartari, sal nitri), различая по вкусу salia acida и salia alcalina, а по летучести: salia alcalina fixa и salia alcalina volatilia; желтые металлические соединения получили название crocus (шафран), а черные — aethiops и т. д. В XVII столетии уже замечаются попытки выразить в названиях близость веществ по составу; так серно-кислые соли стали обозначать словом vitriol (купорос), которое еще в XV веке Basilius Valentinus прилагал ко всем хорошо кристаллизующимся металлическим солям; К 2S04 получило тогда название — tartarus vitriolatus, а иногда, nitrum vitriolatum [Первое название имеет в виду образование КаSО 4 из кислой винно-калиевой соли — cremor tartari, а второе — из калиевой селитры — sal nitri.]; азотно-кислые соли, независимо от основания, были названы salia πέτρης, а хлористые соединения свинца и серебра — роговым свинцом и роговым серебром, но хлористый калий назывался — febrifugum Sylvii; соли одного основания с разными кислотами редко имели нечто общее в названии; иногда даже одно и то же слово употреблялось для обозначения совершенно разных оснований; так, благодаря тому, что при прокаливании перекиси марганца наблюдалось выделение газа и таковое было установлено при прокаливании углекислого магния, первое вещество было названо — magnesia [Переделано впоследствии в manganesia и затем в manganium; перекись марганца называется теперь manganum hyperoxydatum.] nigra, a второе magnesia alba. Только в средине ΧVIII столетия Макер и Боме начали усиленно настаивать на необходимости обозначения подобных по составу веществ подобными же названиями; в 1770 г. к ним присоединился Бергман, но его первые попытки реформы X. номенклатуры были неудачны, потому что они представляли собой не что иное, как более систематическое применение старой номенклатуры; так, напр., едкие щелочи были названы им: alkali vegetable fixum purum (КОН), alkali fossile fixum purum (NaOH), alkali volatile purum (нашатырный спирт), и только значительно позднее (1782) в своей минералогии он их назвал: potassium, natrum и ammoniacum; тогда же им было высказано несколько замечаний, принятых затем Гитон де Морво (см. ниже); а именно, он думал, что каждой кислоте должно быть дано простое название, напр. для серной — vitriolicum, для азотной — nitro s um и т. д., каковое должно служить родовым названием для солей, а их видовое название должно указывать основание, почему продукт взаимодействия с серной кислотой поташа должен называться vitriolicum potassinatum [Тогдашние синонимы: sal de duobus, arcanum duplicatum.], а обыкновенная селитра — nitrosum potassinatum; эта номенклатура не была, впрочем, проведена им последовательно, и в "Sciagraphia" [Sciagraphia regni mineralis появилась в 1782 г.] он для тех же солей употребил названия: alkali vegetabile vi t riolatum и alkali vegetabile nitratum и т. д. Какова была царствовавшая тогда путаница, видно из списка наиболее употребительных синонимов, данного J. Блэком в его "Lectures on the Elements of Chemistry" (см. Флогистон), где для поташа приведено множество названий: potassium, lixiva, alkali fixum vegetabile, kali-Pharm. Lond., potassa-Gallis., sal tartari и др., для соды: sodium, trona, alkali fixum fossile, soda-Pharm. Edin., natron-Lond., а для аммиака: ammonium, ammonia, alkali volatile-Edin., ammoniaca gallis., sal volatile ammoniaci, sal cornu cervi, sal urinae, а для водного раствора: ammonium aqua dilutum, spiritus salis ammoniaci, aqua ammoniae, spiritus cornu cervi, spiritus urinae и т. д. Немудрено поэтому, что незадолго до смерти Бергман (1735—17 8 4) писал де Морво, зная, что последний занят химич. номенклатурой: "Не щадите никакого неподходящего названия; обладающие уже знаниями будут продолжать понимать, а не знающие поймут тогда скорее" (Lavoisier, "Oeuvres etc.", т. 1, стр. 12). Очерк новой X. номенклатуры был напечатан Гитон де Морво в 1782 г. в "Journal de Physique"; она была основана на теории флогистона (см.), но имела некоторые особенности, удержавшиеся до нашего времени. А именно, Гитон первый резко и систематически различил кислоты, основания и соли; первые получили название "acides" (acida [От Асеtum — уксусная кислота.]), они отличались друг от друга прилагательными, указывавшими натуру кислоты; напр., acide vitriolique, acide nitreux (азотная), acide oxalique и т. д.; названия солей были составлены из названия кислот и названия оснований, входивших в их состав; напр. vitriol de cuivre, nitre de mercure; между основаниями были перечислены металлы, алкоголь (винный спирт) и флогистон (см.). Особенности этой X. номенклатуры обратили на себя внимание Лавуазье; ему удалось при личном свидании в Париже убедить де Морво в ошибочности теории флогистона [Гитон сам заявил о своем обращении; см. его "Dictionnaire de chimie de l'Encyciopedie methodique" (1786, l, 625, "Second avertissement")], и учредить при Франц. академии комиссию из Гитон де Морво, самого себя, Бертолле и Фуркруа [Бертолле присоединился к антифлогистическим взглядам Лавуазье, как видно из его заявления Пар. академии наук 6 апреля 1785 г., а де Фуркруа — только в 1787 г.] для выработки новой, антифлогистической X. номенклатуры; доклад комиссии был представлен Академии 18 апр. 1787 г. под заглавием: "M éthode de Nomenclature Chimique, proposé e par MM. de Morveau, Lavoisier, Berthollet et de Fourcroy" и опубликован тогда же "Sous le Priv ilège de l'Acadé mie des Sciences". Элементы, т. е. "вещества, не разложенные до нашего времени" ["Nous attachons au nom d' éléments ο u de principes des corps l'idée du dernier terme auquel parvient l'analyse, toutes les substances que nous n'avoua pu decomposer par aucuu moyen sont pour nous des élé ments" (Lavoisier "Oeuvres etc.", I, 7).], разделены авторами на 5 классов. Первый класс "обнимает собой сущности, которые хотя и не обнаруживают большого взаимного сходства, но имеют между собой то общее обстоятельство, что они, по-видимому, наиболее приближаются к состоянию простоты, благодаря чему, с одной стороны, они противостоят анализу, а с другой — столь деятельны в соединениях"; сюда отнесены: свет (la lumi è re), тепловая материя (la mati ère de la chaleur), дефлогистизированный, или жизненный, воздух (l'air appel é d'abord déphlogistiqué, puis air vital), горючий газ (le gaz inflammable) и флогистизированный воздух (l'air phlogistiqu é), для которых авторы предложили названия: lumi ère, calorique, oxigè ne [От греч. слов οξύς — кислота и γείνομαι — произвожу, зачинаю], hidrog è ne [От греч. слов ύδωρ — вода и γείνομαι)] и азот [От греч. слова α — отрицание и ζωη — жизнь" см. Laroisier "Oeuvres etc.", 1, 48.]. Второй класс обнимает собою "все окисляемые основания (bases acidifiables) или радикалы (см. соотв. статью) кислот: между ними перечислены: азот, углерод, сера, фосфор, le radical muriatique (base muriatique, т. е. то гипотетическое тело, кислородным соединением которого признавался хлор), le radical boracique (современный бор) и т. д., всего 26 тел; 3-й класс заключает тела "главным характерным признаком которых является металлическое состояние", их 17; 4-й класс — "земли", каковы: кремнезем (la silice), глинозем (l'alumine), барит (la baryte; barote было название, предложенное Гитон де Морво в 1779 г. для окисла ВаО, выделенного из тяжелого шпата в 1774 г. Шееле), известь (la chaux) и магнезия (la magn é sie) и, наконец, 5-й состоит из трех щелочей: potassium, sodium, ammonium [Относительно перечисленных земель Lavoisier, кажется, уже в это время подозревал, что они представляют окиси особых металлов; что же касается щелочей, то ввиду X. близости редких щелочей с нашатырным спиртом авторы предполагали присутствие в них азота, содержание которого в аммиаке только что было установлено Berthollet.]. В дополнение к этим 5 классам дан еще список "сложных тел, которые соединяются подобно элементам или не претерпевают при этом заметного изменения", в нем 17 подразделений. Названия перечисленных тел составлены следующим образом. Было принято за правило, что название элемента должно выражаться одним, и притом простым, словом; по возможности, для них было удержано какое-нибудь из имевшихся уже названий; исключения сделаны только в двух случаях, а именно, когда предстояло дать имя недавно открытому элементу, название которого не могло считаться общепринятым, или же когда употреблявшиеся раньше названия заключали в себе какое-нибудь ложное представление (дефлогистизированный воздух, напр., для кислорода) или объединяли совершенно различные вещества: в обоих случаях авторами были образованы новые слова, произведенные от греческих корней, причем новое слово, "не заключая в себе гипотезы", должно было указывать "наиболее общее и наиболее характерное свойство вещества, чтобы облегчить память начинающего, который удерживает с трудом слова, совершенно лишенные смысла, и чтобы приучить его не принимать никакого слова, не связывая с ним определенной идеи" (Lavoisier, "Oeuvres etc.", I, 8). Heсмотря на все эти предосторожности, комиссия не избегла в выбранных ею названиях гипотетического элемента и связанной с ним односторонности. Так, напр., название кислорода — oxyg è ne — предполагало, что присутствие его в соединениях обуславливает их кислые свойства, а "между тем, — замечает Дэви ("Phil. Trans.", 1808 стр. 41) по поводу осуществленного им электролиза окисей калия и натрия, — то тело (O 2), которое французская номенклатура характеризует, как носителя кислотности, одинаково могло бы быть признано за носителя щелочности"; о водородной теории кислот см. Кислоты. Равным образом типом воды еще не исчерпывается X. характер всех водородистых соединений, и, наконец, азот, действующий смертельным образом при вдыхании чистого газа, потому что организм высших животных лишается тогда необходимого для жизни кислорода, совершенно необходим для тех же организмов, как питательный элемент, без которого они не могут существовать. Для номенклатуры наиболее простых бинарных кислородных соединений комиссия воспользовалась тем, что в большинстве случаев реакция их кислая или щелочная; принадлежность соединения к тому или другому классу была обозначена родовыми названиями acide (кислота) или oxyde (окисел — от οξύς), к которым прибавлялось, как видовое, название того элемента, кислородное соединение которого имелось в виду; таковы, напр., названия; acide nitrique (подразумевался, собственно, ангидрид азотной кислоты, в то время, да и долго после того, остававшийся неизвестным), oxyde de zinc, de fer и т. д. Бинарные соединения металлов с серой получили названия sulf u res, с фосфором — phosphures, с углеродом — carbures и т. д.; но сероводород был назван: gaz hydrog è ne sulfure, фосфористый водород — gaz hydrog è ne phosphore, углеводород — gaz hydrog ène carboné и т. д. Названиям кислот было придано окончание прилагательных, а именно, слог ique; при нескольких кислотах, отвечающих низшим и высшим степеням окисления, название кислоты с меньшим содержанием кислорода предложено оканчивать слогом eux, и таким образом появились: acide nitreux (азотистая кисл.) и acide nitrique (азотная кислота), acide sulfureux (сернистая кислота) и acide sulfurique — серная кислота. И в этих названиях проскользнули гипотетические представления. Лавуазье думал, что энергичность кислоты (см. Жадность) определяется количеством кислорода, содержащегося в ангидриде; отсюда проистекло название acide sulfureux — для сернистой кисл., как более слабой и содержащей менее кислорода, чем acide sulfurique, несмотря на то, что в первой кислоте, прямо противоположно ее названию, относительное содержание серы больше, чем во второй, и несмотря на то, что слово sulfureux употреблялось во Франции со времен Сталя для обозначения серной кислоты (ср. Lavoisier, "Oeuvres etc.", I, pp. 10 и 59 и Марковников, "Журн. Рус. Хим. Общ.", III, 1871, 67). Для солей была удержана почти без изменений номенклатура де Морво; было установлено только, что для кислот с одной степенью окисления, названия солей должны оканчиваться слогами ate (borates, muriates [Это наши хлористые металлы, соли хлористо-водородной кисл., в которой предполагалось содержание кислорода — см. выше.], benzoates etc., напр., borates de potasse, de soude, d'ammoniaque, de chaux, de fer и т. под.), а для кислот, содержащих разные количества кислорода — на itе для низших степеней окисления, и на ate — для высших, напр.: nitrites — азотисто-кислые и nitrates — азотно-кислые соли, sulfites — сернисто-кислые и sulfates — серно-кислые соли. Доклад заканчивается статьями: "Synonimie ancienne et nouvelle par ordre alphab é tique" и "Dictionnaire pour la nouvelle Nomenclature Chimique". Во многих отношениях эта X. номенклатура сохранилась без изменения до настоящего времени (ср. Berthelot, "La r é volution chimique", 1890, ch. XIII). После предложения ее, она скоро стала общеупотребительной во Франции и в Англии, где ее первым принял Блэк; больше всего сопротивления оказали немецкие химики, державшиеся сравнительно долго теории флогистона. В 1804 г. Томсон предложил обозначать степени окисления различными приставками, напр. ргоtoxyde, deutoxyde, peroxyde и т. д.; эти названия, с прибавлением sesquioxyde, введенного Гмелином, сохранились во французской и английской химических литературах. В 1812 г. против французской номенклатуры выступил Гумфри Дэви; он исходил из убеждения, что нормально X. номенклатура не должна выражать никаких представлений о телах, так как, напр., разложение какого-нибудь "элемента" на более простые тела должно вызвать целый переворот в установившейся уже номенклатуре; поэтому он находил простонародные названия наиболее пригодными для номенклатуры и считал единственно необходимым, чтобы подобные тела, какова бы ни была их конституция, получили подобные же названия. Так, по номенклатуре Дэви, все металлы могли бы получить латинские названия с окончанием -um: aurum (Au), plumbum (Pb), calcium (Ca), potassium (К), их кислородные соединения могли бы иметь окончание -a вместо um: aura, plumba, calca, potassa и т. д., хлористые соединения кончаться на -ana: aurana, plumbana, calcana и т. д.; это предложение и дополнения его (в 1814 г.) не удержались; в этом отношении предложения, сделанные Берцелиусом в 1811 г., были счастливее. Свою статью ("Journal de Physique", LXXIII, стр. 253 — 286) Берцелиус начинает с изложения мотивов, делающих, по его мнению, необходимой латинскую номенклатуру; они следующие: подобно зоологии и ботанике, химия нуждается в "нормальной" (и международной, очевидно) номенклатуре (таковая с успехом теперь заменяется международным языком химических формул); латинская номенклатура обязательна для фармакопеи, потому что необходимо "пользоваться постоянно одним языком для определения веществ, употребляемых при лечении болезней". Переходя к номенклатуре, он начинает с невесомых сущностей (imponderabilia), к которым относит: electricitas positiva, electricitas negativa, lux, caloricum и magnetismus. Как известно, Лавуазье принадлежит опытное доказательство того, что тепловая материя (calorique) невесома (Lavoisier, "Oeuvres etc.", т. II, p. 619; там же описан — стр. 618 — опыт сжигания фосфора в замкнутом пространстве при сохранении прибором постоянного веса; ср. кроме того Флогистон, см. соотв. статью); тем не менее, до конца Лавуазье был убежден в материальности теплоты [Представление о теплоте, как молекулярном движении, находящееся в "M é moire sur la chaleur" (1788, "Oeuvres etc.", т. II, стр. 283 — 833) par Lavoisier et Laplace, принадлежит по всей вероятности, последнему, по крайней мере, за материальность теплоты Лавуазье высказывается в своем "Trait é élé mentaire de chimie" (1790), "Oeuvres etc.". т. I, стр. 26 — 31.]; Берцелиус присоединяется, след., к этому представлению, хотя замечает (l. с. р. 256), что неизвестно, должны ли imponderabilia считаться материей, энергией (puissance), или явлениями; электричество поставлено во главе потому, что после электролиза щелочей Дэви, и появления его электрохимической теории у Берцелиуса сложилось убеждение в близости если не тожестве, электричества с химическим сродством. Все ponderabilia Берцелиус делит на вещества электроположительные и электроотрицательные, называя первыми вещества, собирающиеся при электролизе у положительного полюса, а вторыми — собирающиеся у отрицательного полюса; кислород поэтому им считается абсолютно электроположительным элементом; такое обозначение не привилось, и мы держимся противоположного, принадлежащего Гумфри Дэви. Затем, все известные вещества делятся на элементы (simplicia) и тела сложные (composita); элементарную натуру Берцелиус считает доказанной только для кислорода (oxigenium), по отношению к которому все остальные тела являются "горючими" (combustibilia) и подразделяются на metallo ï da и metalla. К первым причислены: sulfuricum, phosphoricum, muriaticum, fluoricum, boracicum и carbonicum, расположенные в порядке убывающей электроположительности; приведенными названиями Берцелиус желал отличить элементы от простых тел [В русской номенклатуре это, несомненно, правильное, различие сделано только для углерода, известного нам в виде угля химически чистого, графитов и алмаза]; muriaticum обозначает хлор. Металлы распределены в порядке возрастающей электроотрицательности, а именно: arsenicum, molybdaenum, chromium, wolframium, tellurium, osmium, tantalum, silicium (?), titanium, zirconium, stibium, bismutum, stannum, iridium, platinum, aurum, rhodium, palladium, hydrargyrum, argentum, plumbum, niccolum, cuprum, cobaltum, uranium, zincum, ferrum, manganium, cerium, yttrium, beryllicum, aluminium, magnesium, calcarium, strontium, barytium, natrium, kalium и ammonium; эти названия приняты и в настоящее время, за исключением beryllicum, magnesium, calcarium и barytium, вместо которых имеются: beryllium, magnium (название предложено Г. Дэви), calcium (тоже Дэви) и barium; ammonium не причисляется к металлам, а к гипотетическим радикалам (см.), название которого сохранилось только благодаря инерции химиков. Composita делятся на с. inorganica и с. organica. Первые, в свою очередь, подразделены на: I) combinationes combustibilium cum oxigenio, II) с. combustibil i um. III) с. oxidorum cum acidis, salia и IV) с. oxidorum cum oxidis. Бинарные кислородные соединения по количеству кислорода делятся: на suboxida (напр. suboxidum kalicum и т. д.), на oxida (напр. oxidum kalicum l. kali, natricum l. natron, baryticum l. b a ryta, stronticum l. strontia и т. д., согласно номенклатуре Г. Дэви; между окислами Берцелиус отличает закисные окончанием osum, а окисные — icum, почему FeO — закись железа — называется им oxidum ferrosum, а Fe 2 О 3 — окись железа — oxidum ferricum), на acida (acidum nitrosum и nitricum, sulfurosum и sulfuricum согласно с номенклатурой Лавуазье) и на superoxida (и здесь он отличает superoxidum plumbosum — сурик — Pb 3O4 и s. plumbicum — перекись свинца — PbO 2. Названия соединений других элементов между собой оканчиваются на слоги etum, а потому имеются: sulfuretum hydrogenii, hydrargyretum argenti (амальгама серебра), supersulfuretum, phosphuretum и т. д. В солях название кислот (их ангидридов) оканчивается слогом as для высших степеней окисления и is — для низших; название кислоты является родовым, а название основания, следующего в виде прилагательного, видовым; так, напр., sulphas kalicus, sulphis kalicus, acetas cupricus (теперь даже и по-латыни обыкновенно перевертывают названия и говорят, напр., kali sul f uricum, cuprum aceticum); кислые соли обозначались приставкой super, напр. supersulfas kalicus (KHSO 4) и superoxalas kalicus supremus (KHCO 4 + H2CO4) и т. д.; а основные соли — приставкой sub, напр. subsulfas cupricus; двойные соли имели составные названия, напр. sulfas aluminicokalicus [AlK(SO 4)2], tariras kalico-natricus (C4H4NaKO6). Вода конституционная была названа hydras, напр., hydras kalicus, а вода, как растворитель, обозначалась прилагательным — hydricus (sulfas hydricus, murias hydricus и т. д.); теперь обыкновенно говорят: aqua dilutum или просто dilutum, а конституционную воду обозначают словом hydricum, напр. kali hydricum или kalium oxydatum hydricum. В высшей степени несовершенную номенклатуру органических соединений, предложенную тогда же Берцелиусом, можно оставить в стороне, а также курьезную до нелепости попытку X. номенклатуры Гмелина (его "Handb. d. Ch.", 4-te Aufl., IV, S. 132 u. ff.).
|