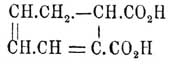|
Иллюстрация к статье на тему "Рацемия". Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
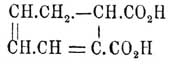
Рацемия - (хим.) — слово, происходящее от французского названия виноградной (см.) кислоты — rac é mique (acide); оно употребляется для обозначения явлений, сопровождающих взаимодействие в молекулярных отношениях оптических антиподов (ср. соотв. ст. и Стереохимия). При этом наблюдается следующее. Продукт взаимодействия (если он тверд) обладает обыкновенно другою кристаллографическою формою: напр. виноградная кислота (см.) кристаллизуется в трехклиномерной системе, между тем как винные кисл. — одноклиномерны (и гемиморфны); рацемический четырехбромистый карвон C 10H14Br4 O — одноклиномерен, его d и l изомеры (ср. Гидраты углерода) — ромбичны (и гемиэдричны) и т. п. Вообще кристаллы оптически деятельных веществ принадлежат к гемиэдричным или тетартоэдричным формам правильной, гексагональной и квадратной систем, к гемиэдричным формам ромбической системы, гемиморфным (сфеноидным) одноклиномерной и гемиэдричным (асимметричным) — трехклиномерной, а кристалы Рацемия соединений к симметричным формам этих систем. Состав рацемических тел очень часто отличается от состава оптически деятельных большим или меньшим содержанием кристаллизационной воды (ср. винные кислоты и виноградную, соли правой и левой молочной кислоты (см.) с солями оптически недеятельной кисл.). Что касается точек плавления, удельных весов рац. форм и их растворимости, то между этими физическими свойствами наблюдается следующее соотношение. Когда точка плавления рап. видоизменения выше точек плавления оптически деятельных антиподов, то и уд. вес его выше (Вальден); так, винные кислоты плавятся при 170°, виноградная кисл. при 204°, уд. в. первых = 1,759, последней высушенной = 1,788 (Либиш); оптически деятельные камфорные кислоты плавятся при 187° С., их рацемическая форма при 202° С. (Вальден); уд. веса первых = 1,188, последней = 1,228; оптически деятельные четырехбромистые дипентены (лимонены, см. Терпены) пл. при 105°С., а рац. форма при 124° С (Валлах), уд. веса первых = 2,134, последней 2,225 (Либиш). Наоборот, когда точка пл. Рацемия формы ниже точек плавления d и l антиподов, то и уд. вес ее ниже (Вальден); напр. оптически деятельные миндальные кислоты (см.) пл. при 132,8° С, а Рацемия форма при 118° С (Левкович), ее уд. вес = 1,300, первых = 1,341 (Вальден), и, наконец, когда точка плавления Рацемия формы совпадает с точками плавления оптических антиподов, то и удельные веса их тоже, по-видимому, совпадают (Ландольт). Пока нет данных для этого случая, на которые можно было бы положиться. В тех случаях, когда точка плавления Рацемия формы лежит ниже точек плавления оптически деятельных веществ, есть возможность, что легкоплавкое вещество представляет собою не что иное как смесь деятельных изомеров (Ландольт). Вальден считает такое представление неправильным; в пользу такого представления Ландольт приводит, что молекулярные количества d и l лактонов гулоновой кисл. (см.) дают оптически недеятельное вещество, пл. при 160° С. (Э. Фишер и Штагель; + и — лактоны плав. при 180° Ц.), но которое повторенными кристаллизациями может быть разделено на деятельные антиподы (Э. Фишер и Кёртисс). Впрочем, разделение кристаллизацией на антиподы возможно, кажется, и для Рацемия форм, обладающих повышенной точкой плавления; по крайней мере, имеется указание (Валлаха), что Рацемия в карвонпентабромид, плав. при 96—98° С (d и l пл. при 86—87° С), при повторенных кристаллизациях понижает точку плавления, которая для отдельных фракций приближается к 87° С. Когда Рацемия формы плавятся выше оптических антиподов, то они растворимы труднее их; так: 100 в. ч. воды при 20° С раствор. 139,4 в. ч. винной кисл. и 17,0 в. ч. виноградной (Лейдье); 6,96 в. ч. d и l камфорных кислот (Юнгфлейш) и 0,239 в. ч. Рацемия камфорной кисл. (Аскан); 100 в. ч. спирта при 15° С раствор. 112 в. ч. d и l камфорных кисл. и 33 ч. Рацемия камфорной (Шотар) и т. д.; когда же Рацемия форма пл. ниже оптических антиподов, то она и более растворима; так: оба оптически деятельных α-лимонен бензоилнитрозохлорида(пл. 109,5° С, Валлах) растворимы в уксусном эфире труднее соответственного соединения дипентена (пл. при 90° С, Валлах); d и l миндальные кисл. раствор. в 100 в. ч. воды при 20° Ц. в количестве 8,64 в. ч., а Рацемия миндальная кисл. в количестве 15,97 в. ч. (Левкович) и т. д.; необходимо, однако, заметить, что все Рацемия формы в растворах диссоциированы до известной степени на d и l антиподы, которые растворяются независимо друг от друга, так что приведенные цифры растворимости Рацемия форм представляют, собственно, суммы растворимостей имеющихся в растворе d, l и r видоизменений. Когда при сливании жидких d и l изомеров получающееся оптически недеятельное вещество остается тоже жидким, то вопрос о том, имеется ли Рацемия, решается довольно трудно, и пока в этом отношении мнения различных ученых не сходятся между собою. Ландольт считает существование жидких рац. соединений в высшей степени сомнительным, Кюстер же думает, что данные растворимости d и l антиподов кониина и их эквивалентной смеси говорят за то, что по крайней мере 16% кониина в растворе смеси присутствует в виде Рацемия формы; в пользу того же говорит, по его (Кюстера) мнению, и то, что при сливании d и l кониинов наблюдается долговременное (до получаса) поглощение тепла (Ладенбург). Смесь 4 г l -кониина с вращательной способностью = —6,3° и 2 г d -кониина с вращательной способностью = +13,2°, имевших в отдельности температуру +19,05°, показала через 1/2 часа +17,65°. Таким образом, можно считать, что пока рац. формы твердо установлены только для некоторых кристаллических тел.
|