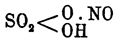|
Иллюстрация к статье на тему "Окислы азота". Статьи для написания рефератов, курсовых работ, научные статьи, биографии, очерки, аннотации, описания.
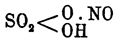
Окислы азота - — С кислородом азот образует ряд соединений N 2O5 — азотный ангидрид [О над-азотной кислоте — см. Крепкая водка.], N 2O4 или NO 2 — азотноватый ангидрид или двуокись азота, N 2O3 — азотистый ангидрид, NO — окись азота, N 2 O — закись азота. Определения Фавра, Томсена, Бертело показали, что при образовании Окислы азота азота из азота и кислорода поглощаются следующие количества тепла: N 2O — 21, N2O2 — 43, N2O3 — 22, N2O4 — 5, N2O5 — 1. Числа эти (выражены в тыс. единиц тепла и вычислены для газообразного состояния) получены не из прямых наблюдений, а из сравнения теплот горения тел (уголь, фосфор) в Окислы азота азота и чистом кислороде (в первом случае выделится больше и именно настолько, насколько эти Окислы азота поглотили тепла при своем образовании; см. Термохимия). Образование Окислы азота азота из азота и кислорода наблюдается лишь при условии притока энергии извне: горении водорода, светильного газа, дерева в воздухе, т. е. реакциях, сопровождающихся выделением тепла; при пропускании электрических искр — так, индуктированный ток (65 вольт и 15 ампер, Крукс) дает пламя азота в кислороде (см. Горение).
|